Животные растения микроорганизмы вирусы генетическая программа которых изменена с использованием
Обновлено: 04.07.2024
В наши дни трансгенные организмы перестают быть редкостью и значение их для биологии и медицины трудно переоценить. Искусственное включение практически любого интересующего исследователей гена позволяет физиологам изучать на трансгенных животных различные отклонения в гомеостазе организма, иммунной системе, в эмбриогенезе и во многих других случаях
Получение трансгенных животных
Исследования в биомедицине сосредоточены в основном на том, чтобы создать широкий спектр моделей заболеваний человека, включая такие, как атеросклероз, диабет, гипертонию, болезнь Альцгеймера, ретинобластому, онкологические и многие другие заболевания. Модели трансгенных животных, как правило мышей, позволяют изучать механизмы развития и лечения болезней человека.
Трансгенные мыши являются также незаменимой модельной системой и для тестирования генетических конструкций перед получением сельскохозяйственных трансгенных животных-биореакторов, способных с молоком продуцировать белки человека.
Наиболее широко используемый метод введения трансгена – микроинъекция в пронуклеусы (мужское и женское ядро) зиготы в тот момент, когда спермий проник в яйцеклетку, и пронуклеусы готовятся к слиянию. Суть метода заключается во введении в мужской пронуклеус с помощью микроманипулятора со стеклянным капилляром (диаметр кончика 1 мкм) раствора экзогенной (чужеродной) ДНК (500—1000 копий гена). Эта процедура проводится под микроскопом со специальной оптикой, позволяющей видеть пронуклеусы в трехмерном измерении.
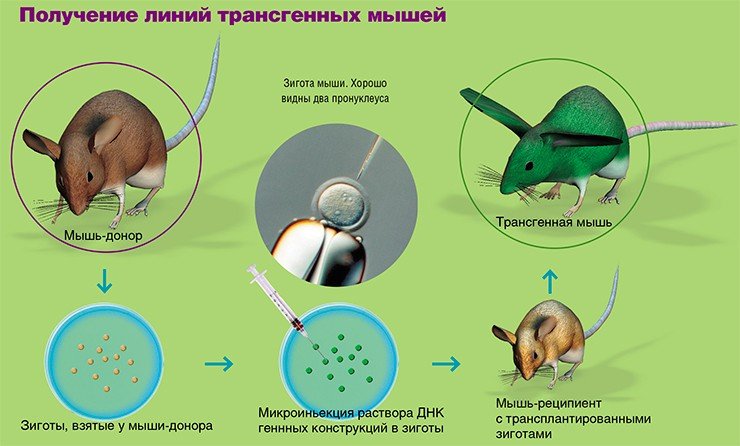
Эффективность интеграции трансгенов в геном, т. е. число трансгенных животных от общего числа родившихся при использовании данного метода в зависимости от вида животных колеблется незначительно. Так, у мышей этот показатель составляет 5—15 %, у свиней – 10—15 %, у кроликов – 10 %, у овец, коз и коров – 5—10 %.
Можно выделить следующие этапы получения трансгенных животных:
1) получение зигот от гормонально стимулированных самок;
2) микроиньекция раствора ДНК генных конструкций в мужской пронуклеус зиготы;
3) трансплантация проинъецированных зигот самкам-реципиентам, подготовленным для вынашивания беременности;
4) анализ родившихся потомков на присутствие трансгена методом полимеразной цепной реакции (ПЦР-анализ);
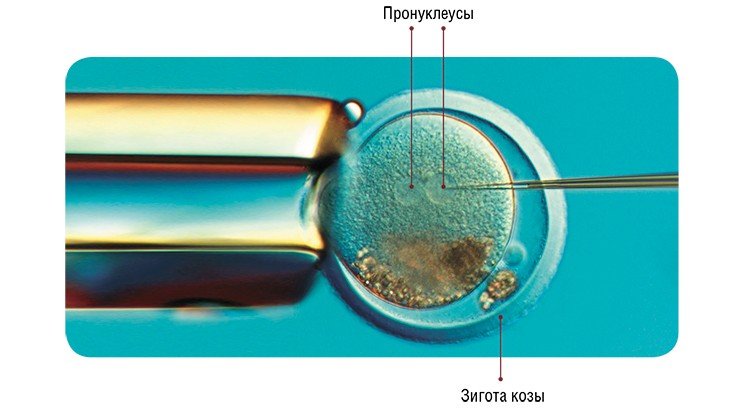
5) анализ трансгенных животных по наследованию трансгена, экспрессии рекомбинантного белка, его биологической активности; необходимо узнать, активен ли встроенный трансген, передается ли он потомкам, обладает ли белок всеми биологическими свойствами его природного аналога и соответствует ли уровень продукции биотехнологическим целям;
6) создание линии (стада) трансгенных животных для научных или биотехнологических целей.
Животные-биореакторы
Получение терапевтически ценных белков человека в молоке трансгенных животных – одно из перспективных направлений современной биотехнологии. Стратегия создания сельскохозяйственных молочных животных в качестве биореакторов основана на введении в управляемую регуляторными элементами одного из «генов молока» коровы, козы или овцы комбинированной генетической конструкции, содержащей последовательность ДНК человека, кодирующую необходимый белок. Согласно этой стратегии, такие трансгенные животные способны синтезировать на высоком уровне белок человека исключительно в молочной железе и секретировать его в молоко, которое в свою очередь становится источником для выделения белка человека.
В настоящее время имеются примеры успешного применения этой технологии, и созданы трансгенные козы, овцы, кролики, свиньи – продуценты человеческих белков: -антитрипсина, сывороточного реактивного белка С, антитромбина, факторов VIII и IX свертываемости крови, лактоферрина, кальцитонина и др. (Wall et al., 1997; Rudolph, 1999; Гольдман и др., 2002).
Фармакологический рынок рекомбинантных белков, полученных из молока трансгенных домашних животных оценивается в 1 млрд долл. в настоящее время и прогнозируется его развитие до 18,6 млрд долл. к 2013 г. (Niemann и др., 2007).
Тестирование новых генно-инженерных конструкций, как правило, производится на трансгенных мышах из-за того, что большинство крупных животных – потенциальных продуцентов лекарственных белков человека имеют длительный репродуктивный период и к тому же дорого обходятся. Анализ генетических конструкций на трансгенных мышах позволяет быстро отобрать из них наиболее перспективные как по уровню продукции заданного белка, так и по его биологическим свойствам.
Проекты по получению трансгенных биореакторов, как правило, состоят из трех частей: создание генетической конструкции, включающей ген человека под управлением регуляторных областей одного из «молочных генов» (например, казеиновых), тестирование ее на трансгенных мышах и, наконец, введение отобранных конструкций в геном молочных животных.

Получение эффективного продуцента – большая удача и гарантия в относительно сжатые сроки создания стада его потомков, обеспечивающих рынок ценным фармакологическим продуктом. При таком стаде создается лаборатория по выделению и очистке рекомбинантного белка, который передается в соответствующие фарминституты для тестирования, проведения его предклинических и клинических испытаний и разрешения применения получаемого лекарства в медицинской практике.
Опыт ведущих фармакологических фирм США, Канады и Англии показывает, что такие проекты длятся около 10 лет при высоком уровне финансирования. С сожалением можно отметить, что в России таких технологий практически нет, как и инфраструктуры для их развития, а это означает, что биологически ценные белки человека мы будем покупать за рубежом. А таких белков уже около 60 (Rudolph, 1999).
К тому же досадно, что российские ученые получили и протестировали на трансгенных мышах несколько эффективных генных конструкций для целей биотехнологии (Завадская и др., 2001; Дворянчиков и др., 2005; Гольдман и др., 1998; Zakharova et al., 2006), однако современных биотехнологических ферм в России нет, и эти разработки пока не используются в полной мере.
Скорее как исключение следует отметить два биотехнологических проекта, развивающихся в России.

В рамках российско-бразильского проекта, о котором рассказывается выше, участвуют Институт цитологии и генетики СО РАН, Институт молекулярной генетики РАН, Государственный университет Рио де Жанейро (UFRJ) и Университет штата Сеара (UECE), в июле 2006 г. получена трансгенная коза с геном Г-КСФ человека, конструкция предварительно была протестирована на трансгенных мышах (Dvoryanchikov et al., 2005). Статья, посвященная получению трансгенной козы опубликована в Журнале Академии наук Бразилии (Freitas et al., 2007). Осенью 2007 г. эксперимент успешно повторен, и в марте 2008 г. родились три трансгенных козленка, из которых сейчас успешно подрастают только двое – Камилла и Августин.
Второй биотехнологический проект на козах, известный нам пока только из популярной прессы, развивается в совместном российско-белорусском проекте с генетической конструкцией лактоферрина человека. Лактоферрин содержится в женском грудном молоке и является природным антибиотиком, защищающим детский организм от всевозможных болезней. Государственными заказчиками программы выступают Федеральное агентство по науке и инновациям России и Национальная академия наук Белоруссии. Основные исследования проводят специалисты Института биологии гена РАН и Научно-практического центра НАН Белоруссии по животноводству. В конце 2007 г. ученые сумели получить двух трансгенных козлят, которые несут ген лактоферрина человека.
Гольдман И. Л. и др. Лактоферин: свойства и перспективы биотехнологического производства // Биотехнология. 1998. № 4. С. 3—16.
Гольдман И. Л. и др. Трансгенные козы в мировой фармаиндустрии ХХI века // Генетика. 2002. Т. 38, № 1. С. 5—21.
Завадская Е. С. и др. Получение рекомбинантного эндостатина в молоке трансгенных мышей // Генетика. 2001. Т. 37. С. 1207—1212.
Dvoryanchikov G. A. et al. Secretion of Biologicaly Active Human Granulocyte Colony-Stimulating Factor (G-CSF) in Milk of transgenic Mice // Russian J. of Genetics. 2005. V. 41, N. 10. P. 1088—1094.
Freitas V. J. et al. Production of transgenic goat (Capra hircus) with human Granulocyte Colony Stimulating Factor (hG-CSF) gene in Brazil // Ann. Braz. Acаd. Sci. 2007. V. 79 N. 4. P. 585—592.
Hubel K. et al. Clinical applications of granulocyte colony-stimulating factor: an update and summary // Ann. Hematol. 2003. V. 82. P. 207—213.
Niemann H. et al. Transgenic farm animals: an update // Reprod. Fertil. Dev. 2007. № 19. 762 р.
Wall R. J. et al. Transgenic dairy cattle: genetic engineering on a large scale // J. Dairy Sci. 1997. V. 80. P. 2213—2224.
Wall R. J. Transgenic livestock: progress and prospects for the future // Theriogenology. 1996. V. 45. P. 57.
Zakharova E. S. et al. Transcription and mRNA splicing of the human lactoferrin gene controlled by the regulatory region of the bovine alphaS1 casein gene in the mammary gland of transgenic mice and in mouse embryonic stem cells // Dokl. Biochem. Biophys. 2006. N. 411. P. 336—338.
Фотоматериалы получены совместно с участником проекта Л. Е. Андреевой (к. б. н., с. н. с. Института молекулярной генетики РАН (Москва)).

Генная инженерия — это современное направление биотехнологии, объединяющее знания, приемы и методики из целого блока смежных наук — генетики, биологии, химии, вирусологии и так далее — чтобы получить новые наследственные свойства организмов.
Перестройка генотипов происходит путем внесения изменений в ДНК (макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов) и РНК (одну из трех основных макромолекул, содержащихся в клетках всех живых организмов).
Если внести в растение, микроорганизм, организм животного или даже человека новые гены, можно наделить его новой желательной характеристикой, которой до этого он никогда не обладал. С этой целью сегодня генная инженерия используется во многих сферах. Например, на ее основе сформировалась отдельная отрасль фармацевтической промышленности, представляющая собой одну из современных ветвей биотехнологии.

История развития
Истоки
Основы классической генетики были заложены в середине XIX века благодаря экспериментам чешского-австрийского биолога Грегора Менделя. Открытые им на примере растений принципы передачи наследственных признаков от родительских организмов к их потомкам в 1865 году, к сожалению, не получили должного внимания у современников, и только в 1900 году Хуго де Фриз и другие европейские ученые независимо друг от друга «переоткрыли» законы наследственности.
Параллельно с этим шел процесс формирования знаний о ДНК. Так, в 1869 году швейцарский биолог Фридрих Мишер открыл факт существования макромолекулы, а в 1910 году американский биолог Томас Хант Морган обнаружил на основе характера наследования мутаций у дрозофил, что гены расположены линейно на хромосомах и образуют группы сцепления. В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
На подъеме
К концу 1960-х годов генетика активно развивалась, а ее важными объектами стали вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов, а в 1970-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК.
Генная инженерия как отдельное направление исследовательской работы зародилась в США в 1972 году, когда в Стэнфордском университете ученые Пол Берг, Стэнли Норман Коэн, Герберт Бойер и их научная группа внедрили новый ген в бактерию кишечной палочки (E. coli), то есть создали первую рекомбинантную ДНК.
Техника ПЦР была впервые разработана в 1980-х годах американским биохимиком Кэри Маллисом. Будущий лауреат Нобелевской премии по химии (1993 года), обнаружил в специфический фермент — ДНК-полимеразу, который участвует в репликации ДНК. Этот фермент буквально считывает отрезки цепи нуклеотидов молекулы и использует их в качестве шаблона для последующего копирования генетической информации.
Новая эра
В 1996 году методом пересадки ядра соматической клетки в цитоплазму яйцеклетки на свет появилось первое клонированное млекопитающее — овца Долли. Это событие стало революционным в истории развития генной инженерии, потому что впервые стало возможным серьезно говорить о создании клонов и выращивании живых организмов на основе молекул.
Технологии генной инженерии
Генная инженерия за короткий срок оказала огромное влияние на развитие различных молекулярно-генетических методов и позволила существенно продвинуться на пути познания генетического аппарата.
Так, появилась технология CRISPR — инструмент редактирования генома. В 2014 году MIT Technology Review назвал его «самым большим биотехнологическим открытием века». Он основан на защитной системе бактерий, которые производят специальные ферменты, позволяющие им защищаться от вирусов.
«Каждый раз, когда бактерия убивает вирус, она разрезает остатки его генома, будь то ДНК или РНК, и сохраняет их внутри последовательности CRISPR, как в архив. Как только вирус атакует снова, бактерия использует информацию из «архива» и быстро производит защитные белки Cas9, в которых заключены фрагменты генома вируса. Если вдруг эти фрагменты совпадают с генетическим материалом нынешнего атакующего вируса, Cas9 как ножницами разрезает захватчика, и бактерия снова в безопасности», — поясняет Алевтина Федина, медицинский директор Checkme.
Уникальное открытие состоялось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье обнаружили, что белок Cas9 можно обмануть. Если дать ему искусственную РНК, синтезированную в лаборатории, то он, найдя в «архиве» соответствие, нападет на нее. Таким образом, с помощью этого белка можно резать геном в нужном месте — и не просто резать, а еще и заменять другими генами.

Теоретически, технология CRISPR может позволить редактировать любую генетическую мутацию и излечивать заболевание, которое она вызывает. Но практические разработки CRISPR в качестве терапии еще только в начальной стадии, и многое еще непонятно.
Есть и другие методы генной инженерии, например, ZFN и TALEN.
- ZFN разрезает ДНК и вставляет туда заготовленный заранее новый фрагмент с помощью белков с ионами цинка (отсюда название — Zinc Finger Nuclease).
- TALEN делает то же самое, только используя TAL-белки. Для обеих технологий приходится создавать отдельные белки, а это очень долгая работа, поэтому пока два этих метода особого применения не нашли.
Где и как применяется генная инженерия
Медицина
Уже сейчас активно применяется инсулин человека (хумулин), полученный посредством рекомбинантных ДНК. Клонированные гены человеческого инсулина были введены в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали. С 1982 года компании США, Японии, Великобритании и других стран производят генно-инженерный инсулин.
Кроме того, несколько сотен новых диагностических препаратов уже введены в медицинскую практику. Среди лекарств, находящихся в стадии клинического изучения, препараты, потенциально лечащие артрозы, сердечно-сосудистые заболевания, онкологию и СПИД. Среди нескольких сотен генно-инженерных компаний 60% заняты именно разработкой и производством лекарственных и диагностических средств.
«В медицине среди достижений генной инженерии сегодня можно выделить терапию рака, а также другие фармакологические новинки — исследования стволовых клеток, новые антибиотики, прицельно бьющие по бактериям, лечение сахарного диабета. Правда, пока все это на стадии исследований, но результаты многообещающие», — говорит Алевтина Федина.
Сельское хозяйство
В сельском хозяйстве одна из важнейших задач генной инженерии — получение растений и животных, устойчивых к вирусам. В настоящее время уже есть виды, способные противостоять воздействию более десятка различных вирусных инфекций.
Еще одна задача связана с защитой растений от насекомых-вредителей. Путем генетической модификации растений можно уменьшить интенсивность обработки полей пестицидами. Например, трансгенные растения картофеля и томатов стали устойчивы к колорадскому жуку, растения хлопчатника — к разным насекомым, в том числе и к хлопковой совке.
Использование генной инженерии позволило сократить применение инсектицидов (препаратов для уничтожения насекомых) на 40–60%.
Благодаря генной инженерии зерновые культуры стали более устойчивы к климатическим условиям, кроме того появилась возможность увеличить количество витаминов и полезных веществ в продукте. Например, можно обогатить рис витамином «А» и выращивать его в тех регионах, где люди имеют массовую нехватку этого элемента.
С помощью генной инженерии пытаются решить и экологические проблемы. Так, уже созданы особые сорта растений с функцией очистки почвы. Они поглощают цинк, никель, кобальт и иные опасные вещества из загрязненных промышленными отходами почв.
Скотоводство
В Кемеровской области работа генетиков позволила получить устойчивое к вирусу лейкоза племенное поголовье высокопродуктивных животных. Для проведения эксперимента кузбасские ученые отобрали здоровых коров черно-пестрой породы массой до 500 кг. Животным трансплантировали модифицированные эмбрионы, устойчивые к вирусу лейкоза. В середине сентября 2020 года родилось 19 телят с измененными генами.
«В месячном возрасте была проведена оценка, которая показала, что телята отличаются от своих сверстников только устойчивостью к вирусу. Пять особей отобрали для дальнейшей селекционной работы. Это позволит закрепить наследственные признаки устойчивости к вирусу лейкоза у последующих поколений», — пояснила руководитель проекта, доктор биологических наук, профессор кафедры зоотехнии Кузбасской ГСХА Татьяна Зубова.
По словам Зубовой, лейкоз крупного рогатого скота — вирусная хронически неизлечимая болезнь, при которой возникают поражение кроветворной системы и новообразования. Данное заболевание наносит значительный ущерб генофонду пород и мясной промышленности в целом, потому что мясо зараженных животных запрещено употреблять в пищу. Единственным доступным методом борьбы с лейкозом ранее было только уничтожение зараженного скота.
Этот успех позволяет говорить о том, что в дальнейшем будет возможно редактировать гены крупного рогатого скота и от других болезней.
С прицелом на человека
В 2009 году группа ученых под руководством молодого исследователя Джея Нейтца из Вашингтонского университета сумели с помощью генной терапии вернуть обезьянам способность различать оттенки зеленого и красного, которой они были лишены от рождения.
В область сетчатки глаза двух подопытных обезьян был введен безвредный вирус, несущий недостающий ген фоточувствительного рецептора. Вскоре после процедуры обе обезьяны начали различать оттенки красного и зеленого на сером фоне. Два года наблюдения не выявили у них каких-либо нарушений, поэтому ученые не исключают, что данную методику уже вскоре можно будет применять у людей, страдающих дальтонизмом.
Ученые шагнули еще дальше и уже пробуют выращивать в теле животных органы для трансплантации людям. Для минимизации риска отторжения тканей животным вводят специальные гены. Этими опытами занимается научная лаборатория Рослинского института в Великобритании, которая представила миру овцу Долли.
В 2019 году британские ученые вывели кур, яйца которых содержат два вида человеческих белков, способных противодействовать артриту и некоторым видам онкологических заболеваний. В яйцах содержится человеческий белок под названием IFNalpha2a, обладающий мощными противовирусными и противораковыми свойствами, а также человеческий и свиной вариант белка под названием макрофаг-CSF, который планируют использовать для создания препарата, стимулирующего самостоятельное заживление поврежденных тканей.
Изменение ДНК человека
Первые клинические испытания методов генной терапии были предприняты 22 мая 1989 года с целью генетического маркирования опухоль-инфильтрующих лимфоцитов в случае прогрессирующей меланомы.
14 сентября 1990 года в Бетесде (США) четырехлетней девочке, страдающей наследственным иммунодефицитом, обусловленным мутацией в гене аденозиндезаминазы (АDA), были пересажены ее собственные лимфоциты.
Работающая копия гена ADA была введена в клетки крови с помощью модифицированного вируса, в результате чего клетки получили возможность самостоятельно производить необходимый белок. Через шесть месяцев количество белых клеток в организме девочки поднялось до нормального уровня.
После этого область генной терапии получила толчок к дальнейшему развитию. С 1990-х годов сотни лабораторий ведут исследования по использованию генной терапии для лечения различных заболеваний. Уже сегодня с помощью генной терапии можно лечить диабет, анемию и некоторые виды онкологии.
Генная терапия
Генная терапия — введение, удаление или изменение генетического материала, в частности ДНК или РНК, в клетке пациента для лечения определенного заболевания.
Существует три основных стратегии использования генной терапии:
- Замена мутировавшего гена, вызывающего заболевание, здоровой копией.
- Инактивация или «выбивание» мутировавших генов, которые функционируют неправильно.
- Введение нового гена в организм, помогающего бороться с болезнью.
Наиболее часто применяемый метод включает вставку «терапевтического» гена для замены «ненормального» или «вызывающего болезнь».
В 2015 году впервые была проведена процедура изменения ДНК человека с целью продления молодости клеток, когда американке Элизабет Пэрриш 44 лет ввели в организм препарат, влияющий на ДНК, а в 2018 году китайский ученый Хэ Цзянькуй заявил, что с его помощью у двух детей-близнецов якобы изменены гены для выработки у них иммунитета к вирусу ВИЧ, носителем которого являлся их отец.
Все это, с одной стороны, выглядит грандиозно и обнадеживает, но с другой, — вызывает опасения, ведь генетические манипуляции, теоретически, возможно использовать не только в благих и мирных целях.
После эксперимента с ДНК близнецов в Китае, ЮНЕСКО выступила с инициативой о запрете изменения генов у новорожденных до того момента, пока достоверно не будет доказана безопасность таких манипуляций.
Этическая сторона вопроса
В 1997 году ЮНЕСКО выпустила Всеобщую декларацию о геноме человека и его правах, рекомендовав мораторий на генетическое вмешательство в зародышевую линию человека, а в декабре 2015 года на международном саммите по геномному редактированию человека изменение гаметоцитов и эмбрионов для генерации наследственных изменений у людей было объявлено безответственным.
Российское сообщество генетиков в большинстве своем считает, что такие эксперименты на данный момент преждевременны и требуют более глубокого исследования и обсуждений.
«Вопрос клонирования уже давно стоит на горизонте. Этично ли выращивать клонов, чтобы потом забирать их органы для трансплантации человеку… Большой вопрос. Само собой, это абсолютно нормально, что нет единой точки зрения, ведь смысл подобных дискуссий как раз в том, чтобы найти правильные формулировки и отрегулировать потенциально спасительное, но при этом очень опасное знание», — говорит Алевтина Федина.
Страх неизвестности
Вариантов развития событий в области генной инженерии существует множество, и далеко не все они изучены и, в принципе, известны. Поэтому они должны быть последовательно зафиксированы и регламентированы.
Естественно, больше всего опасений вызывают плохие сценарии развития событий. Как правило, все начинается с помощи людям и изобретения новых лекарств. Но потом человек может прийти к желанию сделать своего ребенка светловолосым и зеленоглазым или создать армию универсальных солдат, не боящихся боли и не ведающих страха.
Олег Долгицкий, социальный философ, отмечает, что современное общество настолько неоднородно в культурном и экономическом плане, что любые методы, способные существенно изменить геном, могут создать условия не только для классового, но и видового расслоения, где представители «первого мира» смогут существенно продлевать свою жизнь и не бояться никаких болезней, в отличие от менее богатых людей. Это является серьезнейшей почвой для конфликтов и столкновений.
Эксперты убеждены, что генная инженерия — это будущее медицины. Возможность избавить младенца от пожизненного гнета заболевания, излечить людей от рака, найти лекарство против ВИЧ — за всем этим будет стоять генная инженерия. При этом желание человека изменить, например, цвет глаз или предотвратить наследственное заболевание, несмотря на все риски, будет только расти. И похоже, что остановить этот процесс уже не представляется возможным.
Трансгенные животные - это экспериментально полученные животные, содержащие во всех клетках своего организма дополнительную интегрированную с хромосомами чужеродную ДНК (трансген), которая передается по наследству.
Термин «трансгеноз» был предложен в 1973 г. для обозначения переноса генов одних организмов в клетки организмов других видов, в том числе далеких в эволюционном отношении. Получение трансгенных животных осуществляется с помощью переноса клонированных генов (ДНК) в ядра оплодотворенных яйцеклеток (зигот) или эмбриональных стволовых (плюрипотентных) клеток. Затем в репродуктивные органы реципиентной (получающей) самки пересаживают модифицированные зиготы или яйцеклетки, у которых собственное ядро заменено на модифицированное ядро эмбриональных стволовых клеток, либо бластоцисты (эмбрионы), содержащие чужеродную ДНК эмбриональных стволовых клеток.
Первые трансгенные животные были получены в 1974 г. в Кембридже (США) Рудольфом Янишем (Rudolph Jaenisch) в результате инъекции в эмбрион мыши ДНК вируса обезьяны SV40. В 1980 г. американским ученым Жоржем Гордоном (Gordon) с соавторами было предложено использовать для создания трансгенных животных микроинъекцию ДНК в пронуклеус (ядро в яйцеклетке) зиготы. Именно этот подход положил начало широкому распространению технологии получения трансгенных животных. В России первые трансгенные животные появились в 1982 г. С помощью микроинъекций в пронуклеус зиготы в 1985 г. в США были получены первые трансгенные сельскохозяйственные животные (кролик, овца, свинья).
Все имеющиеся методы переноса генов (трансгеноз) пока еще не очень эффективны. Для получения одного трансгенного животного в среднем необходимы микроинъекции ДНК в 40 зигот мышей, 90 зигот козы, 100 зигот свиньи, 110 зигот овцы и в 1600 зигот коровы.
При трансгенозе могут возникать неожиданные проблемы. Одна из первых работ по генетической транформации животных проводились путем встраивания генов гормона роста. Перенос гена гормона роста крысы мышам увеличивал рост мышей в 2 раза. Эксперименты по трансгенозу генов гормона роста быка кроликам также увенчались успехом. А вот аналогичные эксперименты по модификации крупного рогатого скота привели к увеличению прироста всего на 10 20%.
Технология создания трансгенных животных является одной из наиболее бурно развивающихся биотехнологий в последние 10 лет. Трансгенные животные широко используются как для решения большого числа теоретических задач, так и в практических целях для биомедицины и сельского хозяйства.
Уже получены трансгенные коровы и козы, в молоке которых содержится человеческий белок лактоферрин.
Американская корпорация Genzyme Transgenics проводит исследования с целью создания трансгенного крупного рогатого скота, содержащего в молоке человеческий альбумин. Альбумин используется в терапии для поддержания осмотического давления в крови. Genzyme Transgenics занимается разработкой аналогичных методов получения человеческого гормона роста и β интерферона.
В Англии созданы трансгенные овцы, молоко которых содержит фактор свертывания крови.
В России получены свиньи, несущие ген соматотропина. Они не отличались по темпам роста от нормальных животных, но изменение обмена веществ сказалось на содержании жира. Такие трансгенные свиньи были созданы для изучения цепочки биохимических превращений гормона, а побочным эффектом явилось укрепление иммунной системы.
Трансгенных животных получают и для целей ксенотрансплантации (пересадки органов человеку). Одним из излюбленных доноров органов являются свиньи, так как имеется анатомическое сходство органов и сходство иммунологических свойств. Реакции отторжения при трансплантации имеют сложный механизм. Одним из сигналов для атаки организма на чужой орган являются белки, локализованные на внешней поверхности мембраны. У трансгенных свиней эти белки заменены на человеческие.
Существует множество трансгенных животных, моделирующих различные заболевания человека (рак, атеросклероз, ожирение и др.).
В практических целях трансгенные животные используются различными зарубежными фирмами как коммерческие биореакторы, обеспечивающие производство разнообразных медицинских препаратов (антибиотиков, факторов свертываемости крови и др.). Кроме того, перенос новых генов позволяет получать трансгенных животных, отличающихся повышенными продуктивными свойствами (например, усиление роста шерсти у овец, понижение содержания жировой ткани у свиней, изменение свойств молока) или устойчивостью к различным заболеваниям, вызываемым вирусами и другими патогенами. В настоящее время человечество уже использует множество продуктов, получаемых с помощью трансгенных животных: медицинские препараты, органы, пища.
О государственном регулировании в области генно-инженерной деятельности
РОССИЙСКАЯ ФЕДЕРАЦИЯ
ФЕДЕРАЛЬНЫЙ ЗАКОН
О государственном регулировании в области генно-инженерной деятельности
Принят Государственной Думой 5 июня 1996 года
Статья 1. Сфера действия настоящего Федерального закона
Статья 2. Основные понятия
Основные понятия, применяемые в настоящем Федеральном законе:
генная инженерия - совокупность методов и технологий, в том числе технологий получения рекомбинантных рибонуклеиновых и дезоксирибонуклеиновых кислот, по выделению генов из организма, осуществлению манипуляций с генами и введению их в другие организмы;
генная терапия (генотерапия) - совокупность генно-инженерных (биотехнологических) и медицинских методов, направленных на внесение изменений в генетический аппарат соматических клеток человека в целях лечения заболеваний;
генно-инженерная деятельность - деятельность, осуществляемая с использованием методов генной инженерии в целях создания генно-инженерно-модифицированных организмов; (В редакции Федерального закона от 04.10.2010 № 262-ФЗ)
генодиагностика - совокупность методов по выявлению изменений в структуре генома;
генно-инженерно-модифицированный организм - организм или несколько организмов, любое неклеточное, одноклеточное или многоклеточное образование, способные к воспроизводству или передаче наследственного генетического материала, отличные от природных организмов, полученные с применением методов генной инженерии и содержащие генно-инженерный материал, в том числе гены, их фрагменты или комбинации генов;
выпуск генно-инженерно-модифицированных организмов в окружающую среду - действие или бездействие, в результате которых произошло внесение генно-инженерно-модифицированных организмов в окружающую среду (данное понятие не применяется к деятельности, связанной с изменением наследственного генетического материала человека посредством использования методов генной инженерии для целей генной терапии (генотерапии);
защита биологическая - создание и использование в генной инженерии безопасной для человека и объектов окружающей среды комбинации биологического материала, свойства которого исключают нежелательное выживание генно-инженерно-модифицированных организмов в окружающей среде и (или) передачу им генетической информации;
защита физическая - создание и использование специальных технических средств и приемов, предотвращающих выпуск генно-инженерно-модифицированных организмов в окружающую среду и (или) передачу ими генетической информации;
клинические испытания - проверка эффективности и безопасности генной терапии (генотерапии);
(Абзац утратил силу - Федеральный закон от 11.06.2021 № 170-ФЗ)
система открытая - система осуществления генно-инженерной деятельности, предполагающая контакт генно-инженерно-модифицированных организмов с населением и окружающей средой при их намеренном выпуске в окружающую среду, применении в медицинских и алиментарных целях, экспорте и импорте, при передаче технологий;
трансгенные организмы - животные, растения, микроорганизмы, вирусы, генетическая программа которых изменена с использованием методов генной инженерии.
(Статья в редакции Федерального закона от 12.07.2000 № 96-ФЗ)
Статья 3. Законодательство Российской Федерации в области генно-инженерной деятельности
Законодательство Российской Федерации в области генно-инженерной деятельности состоит из настоящего Федерального закона, других федеральных законов и иных нормативных правовых актов Российской Федерации, а также законов и иных нормативных правовых актов субъектов Российской Федерации, нормативных правовых актов органов публичной власти федеральной территории "Сириус". (В редакции Федерального закона от 02.07.2021 № 351-ФЗ)
Нормативными правовыми актами органов публичной власти федеральной территории "Сириус" может устанавливаться специальное регулирование отношений в области осуществления генно-инженерной деятельности в федеральной территории "Сириус" в соответствии с настоящим Федеральным законом и Федеральным законом от 22 декабря 2020 года № 437-ФЗ "О федеральной территории "Сириус". (Часть введена - Федеральный закон от 02.07.2021 № 351-ФЗ)
Статья 4. Задачи государственного регулирования в области генно-инженерной деятельности
Задачами государственного регулирования являются:
установление основных направлений деятельности федеральных органов государственной власти, органов государственной власти субъектов Российской Федерации, органов местного самоуправления, органов публичной власти федеральной территории "Сириус", юридических лиц и граждан (физических лиц) в области генно-инженерной деятельности; (В редакции Федерального закона от 02.07.2021 № 351-ФЗ)
установление основных положений правового регулирования отношений, возникающих в области генно-инженерной деятельности;
определение механизма, обеспечивающего безопасность граждан и окружающей среды в процессе осуществления генно-инженерной деятельности и использования ее результатов;
установление правовых основ международного сотрудничества Российской Федерации в области генно-инженерной деятельности;
создание условий для развития приоритетных направлений в области генно-инженерной деятельности.
Для реализации указанных задач принимаются федеральные и региональные программы, а также программа федеральной территории "Сириус" в области развития генно-инженерной деятельности. (В редакции Федерального закона от 02.07.2021 № 351-ФЗ)
Статья 5. Основные направления государственного регулирования в области генно-инженерной деятельности
Основными направлениями государственного регулирования в области генно-инженерной деятельности являются:
улучшение условий жизни человека и охрана его здоровья;
охрана и восстановление окружающей среды, сохранение биологического разнообразия;
повышение эффективности сельского хозяйства;
повышение эффективности добывающей и перерабатывающей промышленности;
обеспечение сохранения и улучшения кадрового состава, профессиональной подготовки специалистов в области генно-инженерной деятельности;
Генно-инженерная деятельность должна основываться на следующих принципах:
безопасности граждан (физических лиц) и окружающей среды;
безопасности клинических испытаний методов генодиагностики и генной терапии (генотерапии) на уровне соматических клеток; (Абзац введен - Федеральный закон от 12.07.2000 № 96-ФЗ)
общедоступности сведений о безопасности генно-инженерной деятельности;
обязательного подтверждения соответствия продукции, содержащей результаты генно-инженерной деятельности, с указанием полной информации о методах получения и свойствах данного продукта; (В редакции Федерального закона от 30.12.2008 № 313-ФЗ)
Статья 6. Работы в области генно-инженерной деятельности
Генно-инженерная деятельность включает в себя следующие работы:
генетические манипуляции на молекулярном, клеточном уровнях с участием рекомбинантных рибонуклеиновых и дезоксирибонуклеиновых кислот для создания генно-инженерно-модифицированных организмов (вирусов, микроорганизмов, трансгенных растений и трансгенных животных, а также их клеток);
генетические манипуляции на молекулярном, клеточном уровнях с участием рекомбинантных рибонуклеиновых и дезоксирибонуклеиновых кислот для целей генодиагностики и генной терапии (генотерапии) применительно к человеку;
все виды испытаний генно-инженерно-модифицированных организмов, в том числе лабораторные, клинические, полевые, опытно-промышленные;
утилизация отходов генно-инженерной деятельности;
покупка, продажа, обмен, другие сделки и иная деятельность, связанная с генно-инженерными технологиями.
Генно-инженерная деятельность III и IV уровней риска, осуществляемая в замкнутых системах, подлежит лицензированию в соответствии с законодательством Российской Федерации.
(Статья в редакции Федерального закона от 04.10.2010 № 262-ФЗ)
Статья 7. Система безопасности в области генно-инженерной деятельности
Общая координация и разработка системы безопасности в области генно-инженерной деятельности осуществляются в порядке, определяемом Правительством Российской Федерации.
Юридические лица и граждане (физические лица), осуществляющие генно-инженерную деятельность, обязаны обеспечить биологическую и физическую защиту работников организаций, осуществляющих генно-инженерную деятельность, населения, окружающей среды в соответствии с уровнями риска потенциально вредного воздействия генно-инженерной деятельности на человека и окружающую среду.
В зависимости от степени потенциальной опасности, возникающей при осуществлении генно-инженерной деятельности, для замкнутых систем устанавливается четыре уровня риска потенциально вредного воздействия генно-инженерной деятельности на здоровье человека:
I уровень риска соответствует работам, которые не представляют опасности для здоровья человека, и сопоставим с риском при работе с непатогенными микроорганизмами;
II уровень риска соответствует работам, которые представляют незначительную опасность для здоровья человека, и сопоставим с опасностью при работах с условно-патогенными микроорганизмами;
III уровень риска соответствует работам, которые представляют умеренную опасность для здоровья человека, и сопоставим с опасностью при работах с микроорганизмами, потенциально способными к передаче инфекции;
IV уровень риска соответствует работам, которые представляют опасность для здоровья человека, и сопоставим с опасностью при работах с возбудителями особо опасных инфекций.
Работы, проводимые с микроорганизмами в замкнутых системах в масштабе, превышающем лабораторные исследования, относятся к III или IV уровню риска.
(Часть утратила силу - Федеральный закон от 04.10.2010 № 262-ФЗ)
Юридические лица и граждане (физические лица), осуществляющие генно-инженерную деятельность, проводят оценку риска при планировании, подготовке и проведении генно-инженерной деятельности.
(Часть утратила силу - Федеральный закон от 04.10.2010 № 262-ФЗ)
(Часть утратила силу - Федеральный закон от 04.10.2010 № 262-ФЗ)
Статья 8. Требования к лицам, которые осуществляют генно-инженерную деятельность
К занятию генно-инженерной деятельностью допускаются:
граждане (физические лица), профессиональная подготовка и состояние здоровья которых соответствуют требованиям правил безопасности генно-инженерной деятельности;
юридические лица, имеющие соответствующие помещения, оборудование и работников, которые соответствуют требованиям абзаца второго настоящей статьи.
(Часть утратила силу - Федеральный закон от 04.10.2010 № 262-ФЗ)
Статья 9. Финансирование генно-инженерной деятельности и безопасности ее осуществления
Финансирование генно-инженерной деятельности и ее безопасности осуществляется в установленном порядке за счет средств соответствующих бюджетов, целевых средств организаций и фондов, а также иных источников, не запрещенных законодательством Российской Федерации.
Статья 10. Обеспечение общедоступности сведений о безопасности генно-инженерной деятельности
Сведения о безопасности генно-инженерной деятельности являются общедоступными.
Юридические лица и граждане (физические лица), осуществляющие генно-инженерную деятельность, обязаны по просьбе заинтересованных лиц предоставлять информацию об уровне риска и о принимаемых мерах по обеспечению безопасности генно-инженерной деятельности. При этом сведения о генно-инженерной деятельности, составляющие государственную, служебную или коммерческую тайну, предоставляются в установленном порядке.
Статья 11. Сертификация и декларирование соответствия продукции в области генно-инженерной деятельности
В отношении продукции, полученной с применением генно-инженерно-модифицированных организмов и подлежащей обязательной сертификации или декларированию соответствия, выдается сертификат соответствия или принимается декларация о соответствии в порядке, установленном законодательством Российской Федерации о техническом регулировании. (В редакции Федерального закона от 30.12.2008 № 313-ФЗ)
Статья 12. Ответственность в области генно-инженерной деятельности
Юридические лица и граждане (физические лица), которые осуществляют генно-инженерную деятельность и действия или бездействие которых причинили вред работникам организации, осуществляющей генно-инженерную деятельность, населению, окружающей среде, несут ответственность в соответствии с законодательством Российской Федерации.
Статья 13. Международное сотрудничество Российской Федерации в области генно-инженерной деятельности
Российская Федерация заключает международные договоры в целях дальнейшего развития и укрепления международного сотрудничества в области генно-инженерной деятельности.
Статья 14. Вступление в силу настоящего Федерального закона
Настоящий Федеральный закон вступает в силу со дня его официального опубликования.
Генетически модифицированный организм (ГМО) это организм, генотип которого был изменен с помощью методов генной инженерии. Генетические изменения, как правило, осуществляются в научных и сельскохозяйственных целях. Генетическая модификация отличается от естественного и искусственного мутагенеза именно направленной изменением генотипа. При этом генетический материал переносят из одного организма в другой, используя технологию рекомбинантных ДНК. Если при этом ДНК, переносимой, происходит из другого вида, полученные организмы называют трансгенными.
Получение
Основные этапы создания ГМО:
1. Получение изолированного гена. 2. Введение гена в ДНК-вектор. 3. Перенос вектора с геном в организм, модифицирующие (процесс трансформации). 4. Экспрессия генов в трансформированной клетке. 5. Отбор (селекция) трансформированного биологического материала (клона) от нетрансформированного.
Техника введения генов в бактерии была разработана после того, как Фредерик Гриффит открыл явление бактериальной трансформации. В основе этого явления лежит примитивный половой процесс, который у бактерий сопровождается обменом небольшими фрагментами Нехромосомная ДНК, плазмиды. Плазмидные технологии легли в основу введения искусственных генов в бактериальные клетки. Для ввода готового гена в наследственный аппарат клеток растений и животных используют процесс трансфекции.
Если модификации подвергаются одноклеточные организмы или культуры клеток многоклеточных, то на этом этапе начинается клонирование, то есть отбор тех организмов и их потомков (клонов), подвергшихся модификации. В качестве реципиентов, в геном которых встраивают чужеродные гены, используют эмбриональные клетки млекопитающих, некоторых растений, дрозофилы, протопласты растений, микроспоры, зародыши растений и пр. Перенос нужных генов в пределах вектора возможно осуществить с помощью нескольких методов, таких как:
История
Все случаи использования ГМО широко обсуждались в прессе. В 1986 году полемика развернулась вокруг применения созданных с помощью генной инженерии («ice-minus" бактерий). Выходная бактерия живет на многих растениях, делая их чувствительными к заморозкам, поскольку белок, который она выделяет, способствует образованию кристаллов льда на растениях. С помощью генной инженерии были получены так называемые «ice-minus" бактерии, в которых удален ген, кодирующий этот белок. Цель заключалась в том, чтобы разбрызгивая суспензию этих бактерий на растения, сделать их более устойчивыми к заморозкам. Развернулась широкая полемика относительно того, насколько опасным является высвобождение ГМО в окружающую среду, однако в конечном итоге разрешение было получено. После этого случая правила стали более четкими и уменьшились ограничения на использование ГМО Линии ГМО, предназначенные для коммерческого использования, в США в 80-е годы начали проверяться такими государственными структурами как NIH (Национальный институт здоровья) и FDA (Управление по контролю за качеством пищевых продуктов , медикаментов и косметических препаратов). После того, как была доказана безопасность их применения, эти линии организмов получили допуск на рынок.
Широко применяться коммерческое культивирование ГМО начало в середине 1990-х. С тех пор их использования возрастает с каждым годом.
Использование
ГМО используют в биологических и медицинских исследованиях, производстве лекарств, генной терапии и в сельском хозяйстве. С помощью ГМО изучаются закономерности развития некоторых заболеваний, процессы старения и регенерации. Генную инженерию используют для создания новых сортов растений, устойчивых к неблагоприятным условиям среды, гербицидов и вредителей или растений, имеющих улучшенные ростовые и вкусовые качества. Согласно Международной службой по приобретению агро-биотехнических разработок (ISAAA), в 2010 примерно 15000000 фермеров выращивали генетически модифицированные культуры в 29 странах. Общая коммерческая ценность биотехнологических культур, выращенных в 2008 году была оценена в 130 000 000 000 долларов. Больше всего выращивают генетически модифицированную сою, кукурузу и хлопок. Не менее широко используют трансгенных животных. В феврале 2009 FDA одобрила первые биологические лекарства с ГМ животные козы. Препарат ATryn, является антикоагулянтом, который снижает вероятность образования тромбов во время хирургического вмешательства при рождении ребенка. Его экстрагируют из козьего молока.
Выявление и регулирования наличии ГМО
Выявление ГМО в пище осуществляется путем применения таких технологий, как ДНК-микрочип и метод ПЦР. Основными элементами скрининга могут служить такие последовательности, как 35S промотор, Nos терминатор, pat или маркерные ДНК последовательности для официально утвержденных и одобренных для потребления ГМО (Mon810, Bt11, GT73 и др.). Важным моментом во время распространения и коммерциализации ГМО на мировом рынке является маркировка продуктов с содержанием ГМО. Маркировка может быть обязательным или добровольным. В Канаде и США маркировки является добровольным, тогда как в Европе все продукты, содержащие более 0,9% одобренных к использованию ГМО имеют маркироваться. В Украине маркировке подлежат не только продукты полученные из ГМО, а также пищевые добавки, полученные с помощью ГМО. Кроме того, Украина стала первым государством в мире, которая обязала производителей и импортеров пищевых продуктов указывать обозначение "без ГМО" в маркировке всех, без исключения, пищевых продуктов, даже тех, в которых ГМО не может быть ни теоретически, ни практически.
Трансгенные микроорганизмы
Бактерии были первыми организмами, генетически модифицированными в лаборатории Сегодня их используют для различных целей, из которых чрезвычайно важна производство большого количества человеческих белков, которые могут использоваться в медицине.
Например, генетически модифицированные бактерии используют для производства человеческого инсулина. Также бактерии используют для производства факторов свертывания крови для лечения гемофилии,
Трансгенные животные
Один из первых успешных экспериментов по созданию трансгенных животных было проведено на мышах. В геном мыши было встроен ген, кодирующий гормон роста крысы, соединенный с сильным промотором, который стимулировался, если в рационе мышей имелись тяжелые металлы. В результате при кормлении тяжелыми металлами эти мыши росли в два раза быстрее нетрансгенних мышей и достигали вдвое больших размеров. На сегодняшний день при создании трансгенных животных применяют 5 методов:
- введение ДНК в яйцеклетку
- введение ДНК в стволовые клетки
- введение ДНК с помощью векторов на основе вирусов
- трансфекцию
- введение ДНК с помощью липосом
Трансгенные растения
История
Международная база ГМО
На сайте International Service for the Acquisition of Agri-biotech Applications (ISAAA) представлен международный список ГМО 319 пищевых растений, в которые в любое время в любом месте мира были добавлены чужие гены.
Читайте также:

