Аденокарцинома low grade без признаков dmmr msi h что это значит
Обновлено: 04.07.2024
Микросателлитная нестабильность характеризует генетическую изменчивость многих опухолей. Определение данного показателя используется в процессе диагностики рака толстого кишечника, а также для назначения химиотерапевтического лечения.
Синонимы русские
Исследования при колоректальном раке.
Синонимы английские
Microsatellite instability, MSI; high level microsatellite instability, MSI-H; replication error phenotype, RER+.
Какой биоматериал можно использовать для исследования?
Венозную кровь, образец ткани, образец ткани в парафиновом блоке.
Общая информация об исследовании
Гены, которые восстанавливают мутации в ДНК, известны как гены репарации ошибочно спаренных нуклеотидов (mismatch repair, MMR). Существует четыре различных гена репарации, которые отвечают за исправление мутаций в ДНК. Если один из этих четырех генов мутирован, небольшие ошибки в ДНК остаются неисправленными. Эти ошибки приводят к расширению или уменьшению повторяющихся последовательностей в ДНК, что и называется микросателлитной нестабильностью (MSI).
Если человек рождается с мутацией в одном из четырех генов репарации (то есть мутация присутствует во всех клетках его тела), это приводит к синдрому Линча. Синдром Линча является наиболее распространенной наследственной формой рака толстой кишки, на его долю приходится 3 % всех случаев рака толстой кишки.
Тем не менее только небольшая часть опухолей с положительным результатом MSI обусловлена синдромом Линча. Это означает, что большинство MSI-позитивных опухолей возникают спорадически и не обусловлены наследственной мутацией в гене репарации.
Для чего используется исследование?
Микросателлитная нестабильность чаще всего обнаруживается при раке толстого кишечника и является важным прогностическим показателем. Опухоли с высокой степенью MSI не склонны к метастазированию, и их прогноз благоприятный.
Определение MSI проводят при скрининге пациентов, у которых подозревают синдром Линча – наследственный колоректальный рак, который часто сочетается с другими онкозаболеваниями: раком желудка, мочевыводящих путей, яичника, кожи, поджелудочной железы, опухолей головного мозга.
Выявление MSI высокой степени становится показанием для назначения таргетной терапии, то есть влияющей на конкретную генетическую мишень, которая стала причиной онкопроцесса. Этими препаратами являются ингибиторы рецептора PD-1, пембролизумаб и ниволумаб.
Также исследование микросателлитной нестабильности играет роль в определении потенциальной чувствительности опухолей к препаратам из группы 5-фторурацила, простым алкилирующим агентам и производным платины.
Когда назначается исследование?
- Определение прогноза лечения рака толстого кишечника.
- Определение эффективности химиопрепаратов.
- Скрининг синдрома Линча.
Что означают результаты?
В результате исследования отмечается выявление или невыявление микросателлитной нестабильности.
Микросателлитную нестабильность (MSI) обнаруживают примерно в 15 % от всех раков толстого кишечника. Причем частота выявления MSI при колоректальном раке зависит от стадии заболевания, составляя до 22 % при II стадии, до 12 % при III стадии и не более 3-4 % при IV стадии.
Если колоректальный рак или другие опухоли связаны с синдромом Линча, то в 90 % случаев будет обнаружена микросателлитная нестабильность.
Высокий уровень микросателлитной нестабильности MSI означает:
данная опухоль не склонна к образованию метастазов и пациентам со II стадией заболевания можно не проводить адъювантную химиотерапию;
у пациента высока вероятность наличия синдрома Линча;
пациенту показано назначение таргетной химиотерапии (ингибиторы рецептора PD-1, пембролизумаб и ниволумаб).
MSI расшифровывается как «микросателлитная нестабильность». Это - особенность генетического кодирования рака, которая приводит к тому, что опухоль ведет себя определенным образом на микроскопическом уровне.
Микросателлитная нестабильность в онкологии (MSI-high или сокращенно MSI-H) описывает раковые клетки, которые имеют большое количество мутаций (изменений) в микросателлитах.Микросателлиты - это короткие повторяющиеся последовательности ДНК. Раковые клетки c MSI-H могут иметь дефект в способности исправлять ошибки, возникающие при копировании ДНК в клетке.
Микросателлитная нестабильность чаще всего встречается при колоректальном раке, раке желудка и раке эндометрия, но может также обнаруживаться при многих других типах рака. Знание результата анализа на msi при онкологии поможет спланировать лучшее лечение.
Анализ на определение микросателлитной нестабильности MSI
MSI-H приводит к тому, что гены, регулирующие ДНК (называемые генами восстановления несоответствия), не работают правильно. Гены восстановления несоответствия (MMR – mismatched repair) работают как генетические “проверки орфографии”, исправляя ошибки в ДНК по мере деления клеток, подобно тому, как исправляются опечатки в тексте.
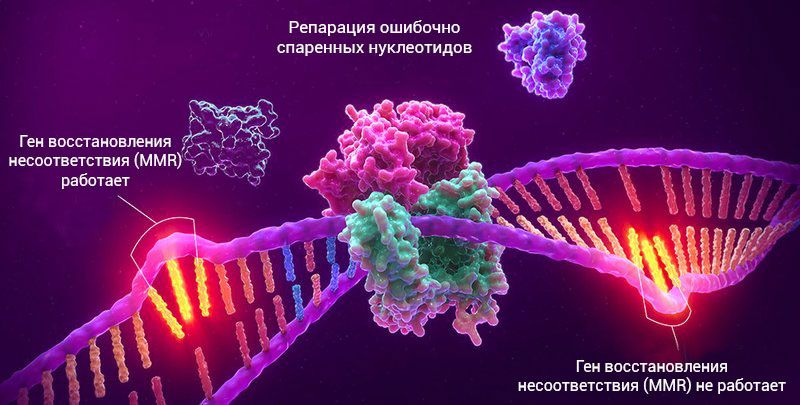
Когда гены MMR перестают функционировать, то некоторые области ДНК могут стать нестабильными из-за накопления ошибок. Скрининговый тест MSI ищет изменения в последовательности ДНК между нормальной тканью и опухолевой тканью и может определить, существует ли высокая степень микросателлитной нестабильности, которая встречается примерно в 15% опухолей колоректального рака. Это часто происходит в опухолях, связанных с наследственным синдромом, синдромом Линча, хотя многие опухоли с высоким уровнем MSI являются спорадическими.
Дополнительный иммуногистохимический тест часто используется, чтобы сделать различие между наследственным и ненаследственным положительным анализом на микросателлитную нестабильность. Если MSI-H наследственная, то есть риск, что члены семьи онкологического больного также могут иметь синдром Линча, поэтому повышается вероятность развития колоректальных или других опухолей.
MSI-Н опухоли могут привлечь внимание иммунной системы. Под микроскопом в этих опухолях часто можно увидеть большое количество клеток иммунной системы. Иммунные клетки просто блокируются от полного выполнения своей работы. Поэтому пациенты с высоким уровнем микросателлитной нестабильности имеют положительный ответ на иммунотерапию. Таким образом, знание вашего состояния MSI чрезвычайно важно для выбора тактики противоопухолевого лечения.
MSS или микросателлитная стабильность обнаруживается приблизительно у 80-85% пациентов с колоректальным раком. Опухоли с мутацией MSS называются” холодными" и с точки зрения количества опухолевых генетических мутаций являются одним из наиболее сильно мутированных типов опухолей.

Аденокарцинома — это развивающаяся из клеток секреторного железистого эпителия опухоль злокачественного характера. Локализуется она на разных внутренних органах, на внутренних оболочках полых органов, а также коже человека.
Отличительной особенностью аденокарциномы является возможность выработки секрета.
Такие опухоли могут иметь самые разные размеры и формы, которые имеют прямую зависимость от клеточных и тканевых функций, клеточной и тканевой структуры органа, который был поражен.
Классификация
Аденокарциному принято классифицировать по локации (органу) поражения, по морфологическому признаку, по гистологическому признаку.
По локации поражения (органу)
Аденокарцинома очень часто поражает такие органы, как:
- Легкие,
- Молочные железы,
- Поджелудочную железу,
- Предстательную железу,
- Пищевод,
- Кишечник.
По гистологическому признаку
Аденокарцинома бывает трех типов:
G1 (Высокодифференцированная)
Такой вид аденокарциномы характеризуется злокачественностью малой степени. Морфология такой аденокарциномы: нормальные и не совсем нормальные клетки, способные быстро размножаться.
G2 (Умеренно дифференцированная)
Состав этой аденокарциномы – злокачественные клетки, сильно отличающиеся от здоровых и способные быстро размножаться. Характер этих раковых опухолей более агрессивен.
G3 (Низкодифференцированная)
Клетки этого вида аденокарциномы характеризуются высокой степенью злокачественности. Для них характерная полная утрата признаков нормальных клеток. Они размножаются активно, непредсказуемо и бессистемно.
По морфологическому признаку
По этому признаку аденокарцинома разделяется на следующие подвиды:
Ацинарная
Такая аденокарцинома являет собой опухоль предстательной железы, диагностируется чаще прочих и имеет долгое бессимптомное течение. При исследовании хорошо видна дифференцировка тканей: раковые клетки различного размера с ядрами и цитоплазмой.
Мелкоацинарная
Это вид рака, находящийся в периферической (чаще всего) предстательной железе или переходной зоне простаты. Она состоит из небольших ацинусов с нарушениями структуры в нескольких местах.
Муцинозная
Аденокарцинома с разными видами клеток, характеризующаяся наличием полости с содержанием муцина. Слизь при этом виде опухоли вырабатывается в больших количествах и выходит на поверхность.
Темноклеточная
Рак, внутри клеток которого находятся полиморфные ядра с преобладающим темным цветом. Структура формируется из этих клеток и цитоплазмы. Имеет железистый вид. Обычно такой подвид аденокарциномы протекает быстро, но все зависит от дифференцировки у новообразования.
Серозная
Рак образуется из дифференцированных полиморфных и клеточных структур. Характер такой опухоли довольно агрессивен.
Светлоклеточная
Такая аденокарцинома имеет кистозно-трубчатую структуру, может иметь железистую структуру. Этот рак также развивается стремительно, при нем часто могут возникать метастазы.
Тубулярная
Структура такой аденокарциномы – цилиндры, трубки и кубики (тубулярные структуры). Локализуются они в фиброзной соединительной ткани.
Фолликулярная
Структура такой аденокарциномы представляет коллоидные частицы. Размер опухоли обратно пропорционален процессу протекания поражения: чем больше опухоль, тем протекание медленнее и наоборот. Метастазы при таком подвиде рака распространяются с током крови по различным частям тела.
Сосочковая (папиллярная)
Структура такого подвида рака похожа на сосочки или папилломы. Именно такой вид аденокарциномы имеет хороший прогноз в большинстве случаев, если вовремя произвести лечение.
Инвазивная
Характеризуется проникновением раковых клеток в близко расположенные с ней органы и ткани. Если вдруг такая карцинома попадает в кровь и лимфу, то распространение по частям тела приобретает гематогенный характер.
Стадии
Выделяют несколько стадий развития аденокарциномы.
Нулевая стадия
По-другому носит название in situ. Злокачественные клетки присутствуют в организме. При этом они не выходят за пределы слоя эпителия.
Первая стадия
Раковые клетки выходят за пределы эпителия, получая распространение в других слоях, но не идут за границы одного органа.
Вторая стадия
Характеризуется разрастанием ракового образования и наличием метастазов в области лимфатических узлов.
Третья стадия
Аденокарцинома распространяется на органы-соседи, давая метастазы в некоторые группы лимфатических узлов.
Четвертая стадия
Раковая опухоль создает метастазы в лимфатические узлы и органы, находящиеся отдаленно от нее.
Причины аденокарциномы
- Застой, воспаление секреции в органе или полости;
- Неправильное питание;
- Ожирение;
- Отсутствие физической активности;
- Влияние химических веществ;
- Наследственность;
- Болезни, которые были перенесены человеком ранее.
Разберем причины, непосредственно связанные с определенными органами, из-за которых возникает аденокарцинома.
Поджелудочная железа
Аденокарцинома, вероятно, образуется в ней из-за курения или панкреатита.

Желудок
Рак может возникнуть из-за наличия Хелибактера и из-за эпителиальных изменений слизистой органа, а также из-за болезни Менетрие (переразвитие слизистой оболочки желудка), полипов, хронических язв.
Простата
Опухоль возникает из-за наследственности, гормональных изменений, связанных с возрастом, вируса XMRV, из-за хронической интоксикации кадмием, дисбаланса нутриентов.
Симптоматика
На скрытом этапе течения заболевания симптоматика отсутствует.
Первые симптомы появляются из-за разрастания опухоли:
- Боль в той зоне, где локализуется новообразование;
- Наличие сгустков крови;
- Появление запоров;
- Рост лимфатических узлов;
- Потеря в весе;
- Снижение гемоглобина;
- Утомляемость;
- Низкая трудоспособность;
- Плохой сон.
На стадии интенсивного роста раковых клеток и появления метастазов выраженность симптомов усиливается.
Разберем симптоматику при формировании аденокарциномы в различных органах.
Кишечник
- Болезненный живот;
- Неприятные ощущения после приема пищи;
- Плохая проходимость кишечника;
- Жидкий стул, чередующийся с запорами;
- Кровь и слизистые выделения в кале.
Пищевод
- Боль при осуществлении глотания;
- Дисгафия;
- Активное слюнотечение.
Полость носа
- Отек миндалин;
- Не проходящее воспаление миндалин;
- Боли в гортани, глотке, носу;
- Неприятные ощущения при глотании;
- Боль в ушах;
- Нарушение речи;
- Увеличение лимфоузлов.
Печень
- Болезненность в области правого ребра и подреберья;
- Глаза и кожа желтоватого цвета.
Диагностика
Лабораторные исследования
Благодаря ним можно предположить, что у человека есть онкология, если у него изменена лейкоцитарная формула, повышен СОЭ, мало эритроцитов в крови. Анализ на кал может показать наличие следов крови (что, конечно, также является симптомом ряда других заболеваний).
Рентгеноскопия
Это исследование помогает определить размер, форму, расположение опухоли. Процедура осуществляется при помощи использования контрастных веществ. Нередко это – барий.
Эндоскопия
В этой процедуре используется энодоскоп. Делается осмотр внутренних органов для того, чтобы диагностировать заболевание или его отсутствие. Во время же этой процедуры также делается биопсия, чтобы исследовать под микроскопом ткань.
Позиторно-эмиссионная и компьютерная томография
Благодаря этим методам можно определить размеры, форму, расположение аденокарциномы, найти, где находятся метастазы.
Ультразвук
Этот метод считается наиболее информативным для изучения аденокарциномы почек и мочевого пузыря. Ультразвуковое исследование позволяет локализовать очаг заболевания, выявить, насколько сильно поражены стенки органа, оценить, в каком состоянии находятся лимфоузлы.
Лечение
Хирургическое вмешательство
Лечение в основном осуществляется при помощи вмешательства со стороны хирургии.
Для поддержания ослабленного организма специалистами назначается курс физиотерапевтических лекарств.
Томотерапия
Одним из новейших методов лечения аденокарциномы стала томотерапия. Благодаря применению специального сканера 3D, который дает изображение зоны поражения в объеме, можно планировать высокоточное вмешательство. Риск при этой операции будет минимальным.
Химиотерапия
Химиотерапия – метод, благодаря которому возможно излечение от данного вида онкологии. Для применения этой терапии нужно смотреть, на какой стадии находится, как распространяется в организме рак.
Если после операции обнаружены лимфоузлы, подвергшиеся поражению, то проводится затем химиотерапия. Длительность курса химиотерапии зависит от самого препарата.
Еще химиотерапия делается при тяжелых случаях, запущенной форме и рецидивах после операции.
Осложнения
Одно из осложнений – распространение метастазов по телу человека с лимфой и кровью. Это может способствовать нарушениям в работе органов и смерти.
Возможно и допущение ошибок со стороны врачей во время хирургического вмешательства и после него.
Прогноз
Для хорошего прогноза нужно диагностировать аденокарциному на начальных стадиях. Если у больного уже есть метастазы, то он будет жить около 4 месяцев, что также будет зависеть от места нахождения очага опухоли.
Если поражен пищевод, то при лечении на первой и второй стадиях заболевания человек живет пять и более лет. При третьей и четвертой степени – смерть в 25% случаях.

Заведующая онкологическим отделением противоопухолевой лекарственной терапии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России, доктор медицинских наук, Москва
Иммунная система является ключевым медиатором в процессе гибели опухоли. Однако злокачественные клетки могут уклоняться от иммунного ответа через ряд механизмов, включая активацию иммуносупрессии, приводя к нерегулируемому росту опухоли. Блокада контрольных иммунных точек высвобождает Т-клеточно-негативную костимуляцию, что позволяет активировать противоопухолевый T клеточный ответ, в результате которого происходит распознавание и уничтожение опухоли [1]. Цитотоксический Т-лимфоцит-ассоциированный антиген-4 (CTLA-4) и рецептор запрограммированной гибели клеток 1 (PD-1) действуют как отрицательные регуляторы, ослабляя нормальную активацию Т-клеток. Рецептор PD-1 экспрессируется на поверхности активированного Т-лимфоцита и ингибирует иммуносупрессивные лиганды PD-1 (PD-L1/PD-L2), которые экспрессируются опухолевыми клетками [2]. В отличие от меланомы, рака легкого и колоректального рака 5, иммунотерапия в монорежиме не демонстрирует высокую противоопухолевую активность при распространенных опухолях гинекологического тракта 8.
Что такое микросателлитная нестабильность
У человека существует сложная система, исправляющая нарушения в ДНК, которые возникают достаточно часто. Одним из таких механизмов является система репарации неспаренных оснований ДНК (mismatch repair system – MMR), которая ответственна за распознавание и удаление неправильно спаренных оснований, образованных в результате ошибок в процессе репликации ДНК. За работу системы репарации неспаренных оснований ДНК отвечают 6 генов: MSH2, MLH1, PMS2, MSH3, MSH6 и MLH3. Наличие герминальных мутаций в этих генах приводит к развитию синдрома Линча. Чаще встречается другой, ненаследственный механизм формирования дефицита MMR (dMMR), в подавляющем большинстве случаев заключающийся в метилировании промотера MLH1 в самой опухоли. В результате dMMR появляется большое число мутаций со сдвигом рамки считывания, что приводит к формированию стоп-кодонов и синтезу нефункциональных белков. Микросателлиты представляют собой короткие последовательности в ДНК из 1-5 оснований, повторяющиеся до нескольких десятков раз. Микросателлиты встречаются и в норме, однако при dMMR их число увеличивается, что и может быть выявлено. Понятия dMMR и микросателлитная нестабильность (MSI) описывают один и тот же процесс. Микросателлитную нестабильность оценивают двумя методами – методом ПЦР и иммуногистохимическим [9].
При определении методом ПЦР выделяются 3 варианта MSI: MSI-Н (высокий уровень MSI), когда ≥2 маркеров нестабильны, MSI-L (низкий уровень MSI), когда нестабилен 1 маркер, и MSS (стабильный уровень), когда стабильны все маркеры. Значение низкого уровня MSI до сих пор четко не установлено, и этих пациентов расценивают как больных с MSS опухолями. Вторым вариантом диагностики dMMR является иммуногистохимическое исследование (ИГХ), когда в опухоли изучается экспрессия белков MSH2, MLH1, PMS2, MSH6. В случае отсутствия окрашивания хотя бы одного белка устанавливается дефицит MMR. Обе методики демонстрируют высокую (>95%) конкордантность и являются в сложных случаях взаимодополняющими, так как существуют редкие варианты нарушения MMR, диагностируемые только ПЦР или только ИГХ.
При раке эндометрия MSI-h/dMMR встречается у 48,2% пациенток с метастатическим процессом и может отличаться от первичной опухоли. В основном в таких опухолях отмечаются недифференцированные или смешанные гистологические варианты с высоким уровнем содержания опухоль-инфильтрирующих лимфоцитов. Часто опухоль локализуется в нижних сегментах матки. Но по данным многочисленных исследований прогноз пациенток с MSI-h/dMMR не отличается от больных с опухолями без нарушений в системе репарации ДНК [10,11].
Рак эндометрия и иммунотерапия
По данным статистики, в 2019 г. было диагностировано 62 000 новых случаев рака эндометрия в мире и, что особо настораживает, прогнозируется рост как заболеваемости, так и смертности со скоростью 1-2% в год [12].
Рак эндометрия – генетически гетерогенное злокачественное новообразование, состоящее из четырех различных фенотипов: POLE ультрамутации, гипермутация микросателлитной нестабильности (MSI), низкая копийность генов и высокая копийность генов [13]. Молекулярная характеристика рака эндометрия имеет большое значение для обоснования использования ингибиторов контрольных точек в этой злокачественной опухоли. В результате дефектной системы репликации ДНК, появления POLE-инактивирующих мутаций и дефекта в системе репарации неспаренных оснований ДНК (MMR) (MLH1, MSH2, MSH6, PMS2) происходит значительное увеличение мутационной нагрузки опухоли [14], котороое коррелирует с высоким уровнем неоантигенов и опухоль-инфильтрирующих лимфоцитов (TIL). Это создает определенное микроокружение опухоли, которое является благоприятным для иммунологического ответа [15]. Большинство рецидивов рака эндометрия имеют либо низкую копийность генов, либо высокую копийность с высокой микросателлитной стабильностью (MSS) опухоли, которые часто являются резистентными для лечения. И разработка новых подходов к лечению именно этой группы больных на сегодня является самой актуальной.
Монотерапия ингибиторами иммунных контрольных точек
В 2017 году в рамках 2 фазы исследования изучали активность пембролизумаба при 12 различных типах опухолей с дефицитом репарации ДНК (dMMR), в том числе были и больные раком эндометрия (N=15), где эффективность терапии была очень впечатляющей и составила 53% [8]. Это исследование также показало, что дефицит MMR является биомаркером ответа на лечение, предлагая новый вариант терапии для злокачественных опухолей с дефицитом MMR.
С 2017 года пембролизумаб одобрен для лечения распространенных форм опухолей с dММR/MSI-H, ранее получавших лечение, включая и рак эндометрия [16]. Также пембролизумаб и анти-PD-L1 препарат атезолизумаб изучались при раке эндометрия у 24 пациенток с PD-L1-положительном статусом опухоли, независимо от MSI статуса, и эффективность этих препаратов составила всего 13% [17, 18]. Во 2 фазе исследования при распространенном раке эндометрия (N=23) применяли монотерапию ниволумабом с эффективность лечения в 23%, независимо от MSI статуса [19].
Во 2 фазе исследования ингибиторы PD-L1 авелумаб (N=31) и дурвалумаб (N=70) показали объективный ответ 26,7% и 43% у пациенток с dММR и 6,25% и 3% со стабильным статусом MMR у пациенток распространенным раком эндометрия соответственно [21, 22]. Также в настоящее время продолжаются исследования монотерапии ингибиторов контрольных точек при рецидивирующем раке эндометрия – ниволумаба и пембролизумаба. В обоих исследованиях производится селекция пациентов в соответствии с MSI, POLE, или dMMR статусом.
Скромные ответы монотерапии ингибиторов контрольных точек подчеркивают общий принцип, что иммуногенность и противоопухолевые ответы зависят в значительной степени от мутагенности опухоли и, следовательно, изменить иммунологический ответ можно в сочетании иммунотерапии с комбинированной терапией.
Комбинация ингибиторов контрольных точек с другими методами лечения
В настоящее время проводится 3 фаза исследования ленватиниба с пембролизумабом в сравнении с доксорубицином или еженедельным паклитакселом в поздних линиях лечения рака эндометрия, а также в первой линии лечения продолжается исследование ленватиниба с пембролизумабом в сравнении с карбоплатином и паклитакселом.
Промежуточные результаты продолжающегося исследования 2 фазы дурвалумаба и тремелимумаба (анти-CTLA-4) в сравнении с одним дурвалумабом при рецидивирующем раке эндометрия независимо от статуса MMR (86% пациентов в каждой когорте были со стабильным статусом MMR) демонстрируют скромные результаты лечения: объективный ответ монотерапии дурвалумабом составил 14,8% и 11,1% при комбинации дурвалумаба с тремелимумабом [23].
До недавнего времени стандартом лечения распространенных форм рака эндометрия и рецидивов являлись монотерапия цитостатиками и гормонотерапия с медианой выживаемости без прогрессирования всего 1,0-3,2 месяца. Но с выявлением ряда биомаркеров подход к лечению такого резистентного к терапии рака, как рак эндометрия, существенно изменился: при опухолях с высокой мутационной нагрузкой (dММR/MSI-H) ингибитор контрольных точек пембролизумаб продемонстрировал высокую эффективность лечения.
Но доля пациентов со стабильным статусом MMR остается очень высокой, и для этой группы больных лечение комбинированной терапией ленватиниба с пембролизумабом является очень перспективным.
Читайте также:

