Зачем в линуксе энтерококки
Обновлено: 01.07.2024
О патогенности энтерококков впервые упоминается в конце XIX в.: MacCallum и Hastings выделили этот микроорганизм из биоматериала больного острым эндокардитом и дали название Micrococcus zymogenes на основании его ферментативных свойств. Микроорганизм был устойчив к нагреванию до 60 °С, а также к различным антисептикам, включая карболовую кислоту и хлороформ. Также было установлено, что при внутрибрюшинном введении белым мышам этот микроб вызывал летальный исход, в экспериментальных условиях Micrococcus zymogenes был причиной эндокардита.
Спустя столетие энтерококки приобрели существенное значение и заняли 2-е место после Е. coli, составив более 12% всех возбудителей нозокомиальных инфекций (НКИ). В последние го/ты, по данным зарубежных авторов, энтерококки как причина НКИ в клиниках интенсивной терапии занимают 3-е место. Энтерококки по антигенному строению (группоспецифическая тейхоевая кислота) отнесены R. Lancefield в начале 1930-х годов к стрептококкам группы D. Четкие отличия энтерококков от стрептококков по ряду признаков указывают на необходимость выделить энтерококки в самостоятельный род.
Это было подтверждено в 1984 г. в сравнительных исследованиях по гибридизации нуклеиновых кислот, а также анализом иммунотипировапия белкового комплекса энтерококков, в котором не обнаружено родства со стрептококками других серологических групп.
В настоящее время Enterococcus spp. разделяют на пять групп:
Группа I - Е. avium, E. gilvus E. malodoralus, Е. pollens, E.pseudoaxnum, Е. raffinosus, E.saccharolyticus.
Группа II - E.faecalis, E.faecium, Lactococcus spp., E. casseliflavus, E.galUnarum, E. mandtii.
Группа III — E. dispar, E. durans, E. hirae, E. porcinus, E. ratli.
Группа IV - E. asini, E. cecorum, E. sulfureus. Группа V E. columbae, Vagococcus spp.
Энтерококки окрашиваются по Граму положительно, представляют собой кокки, факультативные анаэробы. Enterococcus spp. это часть нормальной микрофлоры слизистых оболочек ЖКТ и половых путей женщин. Некоторые особенности этого микроорганизма обеспечивают ему длительное выживание в условиях окружающей среды. Энтерококки способны активно приспосабливаться к различным неблагоприятным факторам, передаваться в условиях стационара от человека к человеку через руки, инструменты. В литературе описаны случаи, когда источником НКИ оказались мобильные телефоны, стетоскопы, термометры и прочие объекты нозокомиальной среды.
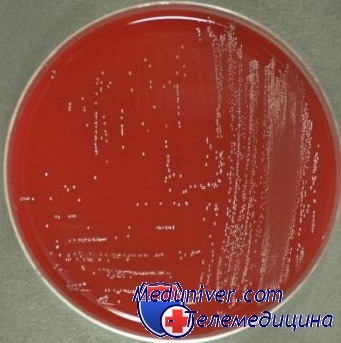
Enterococcus spp. сохраняют жизнеспособность в течение не менее педели на различных поверхностях окружающей среды: на продуктах (например, па сыре — 180 дней), в почве — до 77 дней, на загрязненной одежде до 90 дней; при температуре -70 °С чистая культура энтерококка выживает в течение нескольких лет, на поверхности агара при +4°С -- нескольких месяцев. Энтерококки утрачивают жизнеспособность при автоклавировании при температуре 121 С через 15 мин, при обработке сухим жаром при 160 -170 °С — через час. Эффективные дезинфектанты — 1% гипохлорит, формальдегид, 70% этиловый спирт, 2% глутаральдегид, препараты йода.
Например, резистентность энтерококков к аминогликозидам есть следствие их способности блокировать проникновение препаратов через клеточную стенку. Впрочем, применение аминогликозидов возможно, но в комбинации с препаратами, способными проникать через клеточную стенку микроорганизмов. Следует заметить, что в настоящее время отмечается быстрое распространение штаммов энтерококков с высоким уровнем устойчивости к аминогликозпдам (> 1000 мкг/мл для стрептомицина и >500 мкг/мл для гентамицина), по пока это явление не до конца изучено.
Колонизация слизистых оболочек основное условие развития энтерококковой инфекции. Энтерококки, как уже отмечалось, колонизируют слизистую оболочку ЖКТ у здоровых людей, входя в состав микрофлоры фекалий (103—108 колониеобразующих единиц [КОЕ] в 1 г). Между энтерококками и эпителиальными клетками организма хозяина существует тесная связь, которая препятствует выведению их вследствие естественной подвижности кишечника. Большинство известных микроорганизмов растет в узком диапазоне значений pH, близких к нейтральному. Энтерококки должны преодолеть кислую среду желудка, чтобы попасть в нижние отделы кишечника, что возможно благодаря устойчивости этих микробов к низким значениям pH среды их обитания (pH 3,2-4,8 в течение 15-30 мин).
Прикрепленные бактерии гораздо легче, чем свободноплавающие, образуют кооперативные структуры с другими бактериями. Это особенно важно для развития синтрофной кооперации (вариант кооперации, при которой оба партнера полностью зависят друг от друга в своей жизнедеятельности). В прикрепленных бактериальных сообществах имеются более существенные возможности обмена плазмидами или эписомами. Плазмиды - это специальные внехромосомные генетические элементы, ответственные за внехромосомную передачу резистентности к одному или нескольким антимикробным препаратам. Энтерококки способны прикрепляться к эпителиальным клеткам различных отделов тонкой и толстой кишки, а затем проникать из просвета тонкой кишки через мезентериальные лимфоузлы в печень, селезенку.
Лечение антимикробными препаратами предрасполагает к развитию энтерококковых инфекций. Антибиотик-индуцированный усиленный рост Е. faecalis при соответствующих условиях (например, мукозит, энтеропатия) может привести к проникновению микроорганизма в кровь, что часто проявляется лихорадкой неясной этиологии. Механизм этот до конца не изучен.
Первый активный защитный барьер хозяина представляют различные типы клеток и гуморальных факторов иммунной системы, которые атакуют проникающие микроорганизмы. Фагоциты поглощают и лизируют патогенные микроорганизмы, очищая организм от них. Фагоцитированные микробные клетки оказываются внутри вакуоли (фагосомы), которая сливается с лизосомами и образует фаголизосому, внутри которой микробы подвергаются воздействию бактерицидных механизмов, зависящих и не зависящих от кислорода. В фаголизосоме образуются токсичные формы кислорода (супероксид-анион, пероксид водорода, синглетный кислород и гидроксил-радикал), которые вместе с другими антимикробными соединениями и оксидами азота вызывают гибель микроорганизмов.
Некоторые микробы способны избегать действия бактерицидных механизмов. Одно из предположений состоит в том, что фагоцитированные, но не лизированные тканевыми макрофагами энтерококки проникают через стенку кишки в лимфатическую систему, что приводит к системному распространению этого возбудителя.
E. faecalis отличаемся от Е. faecium мощной продукцией супероксид-аниона. Установлено, что основная часть штаммов Е. faecalis образует супероксид-анион, тогда как среди рода E. faecium такие штаммы встречаются менее часто. Покапано, что штаммы Е. faecalis, выделенные из крови больных, вырабатывают супероксид-анион на 60% больше, чем штаммы, выделенные из фекалий. Пока остается неясным, какую роль играет способность вырабатывать супероксид-анион в патогенезе энтерококковых инфекций. Возможно, штаммы энтерококков, отличающиеся мощной продукцией супероксид-аниона, способны лучше использовать среду своего обитания, лучше физиологически адаптированы к утилизации ограниченных ресурсов кишечника в условиях огромной конкуренции, что ведет к усилению их роста.
Готовность колонизировать слизистые оболочки хозяина, уже заселенные другими микробными сообществами, считают одной из загадок нозокомиальных энтерококковых инфекций. В связи с этим можно считать вполне обоснованным мнение, что активное применение цефалоспоринов III поколения - важный фактор риска колонизации и развития, энтерококковой инфекции в условиях стационара. Эти инфекции часто обусловлены полирезистентными штаммами энтерококков экзогенного происхождения, которые вынуждены конкурировать с эндогенными энтерококками за места обитания в организме хозяина. Показано, что госпитальные штаммы могут вырабатывать поверхностный белок новой структуры, который был обнаружен у 40% штаммов при эндокардитах, у 29% штаммов при бактериемии и у 3% штаммов, выделенных из фекалий. Функция этого белка в биологии Е. faecalis пока неизвестна, по не исключено его значение для колонизации экзогенных штаммов энтерококков.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Как часто бывает, что привычные, казалось бы, вещи становятся опасными. Так и с микроорганизмами. Например, энтерококки, которые едва ли не в первые дни жизни ребенка колонизируют кишечник, вдруг становятся источниками серьезных заболеваний.
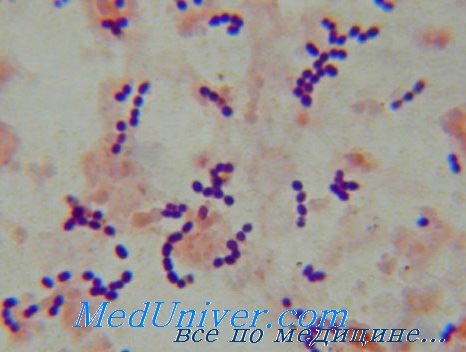
Форма у энтерококков чаще всего овальная, хотя бывает и округлая . Располагаться в мазке они могут как цепочками, так и попарно, а нередко и поодиночке. Оптимальная температура для роста и размножения у бактерий рода Enterococcus составляет +35 0 С … 37 0 С. Но они могут сохранять жизнеспособность, а также репродуктивные свойства и при температуре +10 0 С и вплоть до 45 0 С. Благодаря тому, что эти бактерии могут переключаться с бродильного на дыхательный обмен веществ (метаболизм), что позволяет им существовать как в среде, богатой кислородом, так и в условиях с очень низким его содержанием.
Из рода Enterococcus, который относится к порядку лактобактерий, наибольшую важность для человека представляют два вида: Enterococcus faecalis и Enterococcus faecium. Первый составляет от 90 до 95% представителей рода в кишечнике, второй, соответственно – от 5 до 10%. Практически до конца прошлого века было принято относить энтерококки к стрептококкам группы D, но сейчас их выделили в отдельный род. Хотя не все исследователи с этим согласны, но большой роли для обычных людей это не играет. Гораздо важнее те функции, которые выполняют энтерококки в организме.
Обитают эти бактерии преимущественно в тонком кишечнике. Но немалое их количество находится и в толстом кишечнике, а также они встречаются в небольших количествах во рту и в половых органах. У детей в возрасте до года количество энтерококков в кале составляет до 100 000 000 клеток на 1 г. фекалий. Как постоянные представители микрофлоры кишечника, энтерококки участвуют в усвоении сахаров, синтезе витаминов, уничтожении патогенных микроорганизмов. Но во всякой «бочке меда» в отношении бактерий обязательно должна быть «ложка дегтя». Несмотря на все замечательные свойства энтерококков как постоянных обитателей микрофлоры кишечника, они могут оказаться весьма опасными.
Поскольку энтерококки обитают в весьма агрессивной среде, они приобрели массу свойств, помогающих им бороться за существование. Приверженность медиков к антибиотикотерапии привела к тому, что в последние 20 лет появилось множество штаммов, способные вызывать внутрибольничные инфекции. Воздействие большого количества разных антибиотиков в больницах губит часть бактерий, но оставшиеся в живых и сохранившие способность к размножению особи приобретают резистентность (устойчивость) к этим антибиотическим препаратам. Как говорится – что нас не убивает, то делает сильнее. В истории медицины случались даже эпидемии внутрибольничных инфекций, вызванных энтерококками. Последняя случилась совсем недавно (в 2005 году) в Сингапуре.
Энтерококки вызывают следующие заболевания: дивертикулит, менингит, бактериемия, поражения мочеполовой системы. Особенно часто энтерококковые циститы и уретриты имеют место у беременных. Немецкие исследователи обнаруживали энтерококки в различных процессах нагноения при аппендиците, парапроктите. Практически каждый второй случай воспаления желчных путей сопровождался выделением энтерококков в анализах. Иногда эти бактерии могут вызывать плевриты, сепсис и эндокардит. Хронические энтериты у младенцев также могут быть вызваны бактериями рода Enterococcus. Постоперационные гнойные инфекции, а также воспалительные заболевания, вызванные длительной катетеризацией мочевыводящих путей, нередко вызываются энтерококками в ассоциациях с другими патогенными микроорганизмами. Встречались даже отдельные случаи, когда энтерококки были выделены в качестве единственного источника заражения. Энтерококки вызывают пищевые отравления и кишечные дисбактериозы. Хотя, видимо, не всегда и только у тех людей, которые имеют ослабленную иммунную систему. Ведь в сыр сорта «Чеддер» для улучшения вкуса добавляют культуру энтерококков. До сих пор вроде бы не было массовых случаев острых пищевых отравлений этим видом сыров.
Состояние иммунной системы играет важную роль в профилактике и лечении заболеваний, вызываемых энтерококками. И в этой связи хотелось бы отметить такой немалозначимый аспект, как микрофлора желудочно-кишечного тракта. Баланс лакто- и бифидобактерий, которые сосуществуют в норме с энтерококками и регулируют их численность, может быть нарушен. Способствуют этому явлению различные стрессовые факторы и заболевания, а также прием антибиотиков. У младенцев иммунная система еще не развита и, как следствие, любое лечение антибиотиками может вызвать серьезные дисбактериозы, в которых принимают участие как различные энтеробактерии, так и энтерококки. Поэтому в составе комплексного лечения и для профилактики подобных явлений необходимо восстанавливать баланс бактерий в организме.
В желудочно-кишечном тракте человека в норме обитает более 400 видов бактерий [1]. Особенно высока их концентрация в нижнем отделе толстой кишки, где число бактериальных клеток достигает 1010–1012 на 1 г кишечного содержимого и примерно в 10 раз превышает число тканевых клеток организма человека.
Микрофлора кишечника выполняет множественные функции (табл. 1) и играет важную роль в поддержании нормальной жизнедеятельности человека. Она обеспечивает колонизационную резистентность открытых полостей организма хозяина, стимуляцию кишечного ангиогенеза и иммунного статуса, регуляцию липидного обмена, поддержание оптимального уровня метаболических и ферментативных процессов, антитоксическое, антимутагенное, антиканцерогенное и другие действия [2]. Нормальная микрофлора (микробиота) полностью обеспечивает потребности человека в витаминах В6, В12 и Н (биотине).
Таблица 1. Основные функции микробиоты (нормальной микрофлоры) [2]
Функция
Механизм реализации
Колонизационная резистентность
Межмикробный антагонизм (продукция органических кислот, перекиси водорода, мурамидазы, бактерицинов, микроцинов и др. антагонистически активных веществ).
Активация иммунной системы (активация фагоцитоза, индукция синтеза иммуноглобулинов, лизоцима, интерферона, цитокинов).
Детоксикационная
Гидролиз продуктов метаболизма белков, липидов, углеводов, деконъюгация желчных и гидроксилирование жирных кислот, инактивация гистамина, ксенобиотиков и др.
Синтетическая
Образование аминокислот, летучих жирных кислот витаминов, гормонов, биоактивных аминов и других биологически активных веществ.
Пищеварительная
Усиление активности ферментов, пищеварительной и моторной функции желудочно-кишечного тракта.
Нарушение микроэкологического равновесия кишечника приводит к неблагоприятным медицинским, экологическим и социальным последствиям. Изменение микробиоценоза кишечника сопровождается различными нарушениями жизненно важных функций организма, играя важную роль в патогенезе широко распространенных заболеваний (табл. 2) и утяжелении течения хронических патологий. Оно способствует возникновению и распространению антибиотикорезистентных штаммов микроорганизмов, формированию новых микробных сообществ, увеличению числа лиц со сниженной устойчивостью к инфекциям и расширению спектра заболеваний, связанных с микробным фактором [3]. Кроме того, дисбиоз может быть причиной изменения биотрансформации и снижения эффективности нутриентов и лекарственных средств, что осложняет лечение больных. У женщин с нарушениями микробиоты возможно снижение эффективности гормональных противозачаточных препаратов и возникновение нежелательной беременности.
Нарушение микрофлоры кишечника могут вызывать различные факторы окружающей среды - промышленные яды, пестициды, радиация и т.д. Важную роль в формировании дисбиоза играет и лекарственная терапия, особенно нерациональная. Среди фармакологических средств наибольшее значение в нарушении микроэкологического баланса принадлежит антимикробным и противоопухолевых препаратам, а также пищевым добавкам, применение которых необоснованно растет в последние годы. Все эти факторы являются причиной постоянного увеличения распространенности микроэкологического дисбаланса, который уже на сегодняшний день встречается более чем у 90% россиян [3].
Таблица 2. Клинические синдромы и состояния, этиопатогенез которых может быть обусловлен нарушением состава и функций микрофлоры человека [3]
- Диареи, запоры, колиты, синдром раздраженной кишки
- Гастриты, дуодениты, язвенная болезнь желудка и двенадцатиперстной кишки
- Гипо- и гипертензия
- Острая мезентериальная ишемия
- Гипо- и гиперхолестеринемия
- Коагулопатии
- Ревматоидные артриты, спондилоартриты, другие поражения суставов и соединительной ткани
- Злокачественные новообразования желудка, толстой кишки, грудной железы
- Нарушения менструального цикла
- Кариес
- Мочекаменная и желчекаменная болезни
- Бронхиальная астма, атопические дерматиты, пищевая аллергия, другие аллергические проявления
- Портальная системная энцефалопатия
- Оппортунистические эндо- и суперинфекции различной локализации
- Подагра и другие нарушения водно-солевого обмена
- Инсулиннезависимый сахарный диабет
- Синдром «трансплантант против хозяина»
- Бесплодие, преждевременные роды
- Неонатальная анемия, кахексия
- Снижение эффективности гормональных противозачаточных средств
- Синдром «трансплантант против хозяина»
- Неонатальная анемия, кахексия
Важной вехой в борьбе с дисбиозом стала разработка и внедрение в клиническую практику «живых» лекарств – пробиотиков. В настоящее время применение пробиотиков рассматривают как стратегическое направление альтернативной медицины, направленное на поддержание и восстановление здоровья человека [3].
Определение, механизмы действия и классификация пробиотиков
Согласно определению ВОЗ, пробиотики - это живые микроорганизмы, приносящие при введении в адекватном количестве пользу здоровью хозяина [4]. При приеме внутрь они колонизируют слизистую оболочку соответствующих отделов кишечника, изменяют рН и содержание кислорода до уровня, при котором погибает патогенная микрофлора, препятствуют повреждению слизистой оболочки кишечника патогенными микроорганизмами и секретируют биологически активные вещества – органические кислоты, бактериоцины и другие ингибиторные протеины, подавляющие рост и размножение патогенных и условно патогенных микроорганизмов. Пробиотики также оказывают благоприятное влияние на ферментативную и моторную активность желудочно-кишечного тракта, оказывают детоксикационное действие, в том числе в отношении канцерогенов, стимулируют иммунную систему хозяина [2, 5, 6].
Классификации пробиотиков основываются на количестве микроорганизмов, входящих в препарат, их родовой принадлежности или наличии дополнительных компонентов в составе препарата. Пробиотики подразделяют на монокомпонентные (монопробиотики), монокомпонентные сорбированные, поликомпонентные (полипробиотики), комбинированные (синбиотики); на бифидосодержащие, лактосодержащие, колисодержащие и состоящие из споровых бактерий и сахаромицет (самоэлиминирующиеся антагонисты) [7].
Выделяют 4 поколения пробиотиков [8]. К первому поколению относят монокомпонентные препараты (Колибактерин, Бифидумбактерин, Лактобактерин), содержащие один штамм бактерий. Препараты второго поколения (Бактисубтил, Биоспорин и Споробактерин) основаны на неспецифических для человека микроорганизмах и являются самоэлиминирующимися антагонистами [7]. Они могут применяться для лечения тяжелых форм дисбактериозов, но обязательно в сочетании с бифидо- и лактосодержащими пробиотиками, необходимыми для нормализации микробиоценоза кишечника [9]. Препараты третьего поколения включают поликомпонентные пробиотики, содержащие несколько симбиотических штаммов бактерий одного вида (Ацилакт, Аципол) или разных (Линекс, Бифиформ) видов, усиливающих действие друг-друга. Они имеют более сбалансированный состав по сравнению с препаратами первого поколения, и являются новой вехой в лечении дисбактериозов. Особенно преимущества препаратов третьего поколения проявляются у больных с субкомпенсированным и декомпенсированным дисбактериозом кишечника [10].
К IV поколению относятся препараты иммобилизованных на сорбенте бифидосодержащих пробиотиков (Бифидумбактерин форте, Пробифор). Сорбированные бифидобактерии эффективно колонизируют слизистую оболочку кишечника, оказывая более выраженное протективное действие, чем несорбированные аналоги [8].
Требования, предъявляемые к пробиотикам
Современный пробиотик должны соответствовать следующим критериям:
- содержать микроорганизмы, пробиотический эффект которых доказан в рандомизированных контролируемых исследованиях;
- обладать стабильной клинической эффективностью;
- быть непатогенным и нетоксичным, не вызывать побочных эффектов при длительном применении;
- оказывать положительный эффект на организм хозяина, например увеличивать резистентность к инфекциям
- обладать колонизационным потенциалом, т. е. сохраняться в пищеварительном тракте до достижения максимального положительного эффекта (быть устойчивым к низкой кислотности, органическим и желчным кислотам, антимикробным токсинам и ферментам, продуцируемым патогенной микрофлорой);
- быть стабильным и сохранять жизнеспособные бактерии в течение длительного срока хранения [11, 12].
Принципиальные требования предъявляются и к штаммам бактерий, на основе которых создаются пробиотики:
- они должны быть выделены от здоровых людей и идентифицированы до вида по фено- и генотипическим признакам;
- должны иметь генетический паспорт,
- должны обладать широким спектром антагонистической активности в отношении патогенных и условнопатогенных микроорганизмов;
- не должны угнетать нормальный микробиоценоз;
- должны быть безопасны для людей, включая иммунологическую безопасность
- производственные штаммы должны быть стабильны по биологической активности и удовлетворять технологическим требованиям [13].
В связи с более сбалансированным действием в настоящее преимущество рекомендуется отдавать комбинированным пробиотикам III поколения. Среди них наиболее широкое применение получил Линекс, удовлетворяющий практически всем выше перечисленным критериям [12].
Состав, фармакологические свойства, эффективность и безопасность Линекса
Основную роль в поддержании нормобиоценоза играют представители 4 родов микроорганизмов - Bifidobacterium, Lactobacillus, Enterococcus и Escherichia. Линекс содержит выделенные у здоровых людей живые лиофилизированные бактерии, относящиеся к трем из этих родов – Lactobacillus acidophilus, Bifidobacterium infantis v.liberorum и нетоксигенный молочнокиcлый Streptococcus (Enterococcus) faecium. В одной капсуле препарата содержится не менее 1,2 х 10 7 КОЕ каждого штамма.
Сбалансированность состава Линекса, прежде всего, подтверждается тем фактом, что его компоненты позволяют обеспечить нормализацию физиологических функций микрофлоры во всех отделах кишечника – начиная от тонкой кишки и кончая прямой (энтерококки преимущественно заселяют тонкий кишечник, лактобактерии – нижние отделы тонкой кишки и толстый кишечник, а бифидобактерии – толстый кишечник). Лактобактерии могут колонизировать даже желудок, что имеет важное значение в плане их антагонистического действия в отношении H. pylori [14].
Достоинством Линекса является и то, что он обеспечивает поступление "лечебной" микрофлоры в количественно и качественно сбалансированных соотношениях [15].
Лакто- и бифидобактерии являются продуцентами молочной кислоты и составляют основу облигатной кишечной микрофлоры. Они восстанавливают нарушенный баланс микрофлоры, обеспечивают ее стабилизацию и целостность эпителиальных клеточных образований, стимулируют иммунологические функции слизистой оболочки желудочно-кишечного тракта.
Лактобактерии синтезируют разнообразные соединения, угнетающие рост многих патогенных микроорганизмов, включая вирусы, бактерии (кишечную и синегнойную палочку, золотистого стафилококка, сальмонелл, шигелл, протея, клебсиелл, серраций, холерный вибрион и др.), грибы Candida albicans и некоторых простейших, например, лейшманий. Бифидобактерии также препятствует размножению патогенной, гнилостной и газообразующей микрофлоры кишечника, преимущественно за счет образования органических кислот и снижения рН в кишечнике. Они лучше лактобактерий защищают слизистую оболочку кишечника и подавляют патогенные и условнопатогенные микроорганизмы в толстой кишке, где сосредоточено их основное количество.
Энтерококки осуществляют метаболизм бродильного типа, ферментируют разнообразные углеводы с образованием в основном молочной кислоты, но не газа, и снижая рН до 4.2-4.6 . Считают, что они обладают более выраженным иммуномодулирующим действием, чем другие основные представители нормальной микрофлоры.
Комбинация микроорганизмов, входящих в состав Линекса, обеспечивает бактерицидное и антидиарейное действие.
Помимо создания неблагоприятных условий для размножения и жизнедеятельности патогенных микроорганизмов, бактерии, содержащиеся в Линексе, участвуют в синтезе различных витаминов (В1, В2, В3, В6, В12, биотина, РР, К, Е, фолиевой и аскорбиновой киcлот). Снижая рН кишечного содержимого, они создают благоприятные условия для всасывания железа, кальция и витамина D, нормализуют пищеварительную функцию путем ферментативного расщепление белков, жиров и сложных углеводов, в том числе при лактазной недостаточности. Под влиянием бифидобактерий белки и углеводы, не всосавшиеся в тонкой кишке, подвергаются более глубокому расщеплению в толстой кишке. Компоненты Линекса участвуют в метаболизме желчных киcлот (образовании стеркобилина, копростерина, дезоксихолевой и литохолевой киcлот; реабсорбции желчных киcлот). У грудных детей бифидобактерии, содержащие фермент фосфопротеин-фосфатазу, способствуют перевариванию казеина молока [15]. Сбалансированный состав Линекса позволяет осуществлять и другие функции нормальной микрофлоры (табл. 1). Препарат достаточно эффективен в устранении гиповитаминозов и дефицита микроэлементов [15].
Следует подчеркнуть, в состав Линекса входят штаммы микроорганизмов, которые при выращивании на средах, содержащих антибиотики и химиотерапевтические средства, сохранили способность к дальнейшему размножению, поэтому резистентны к их действию. Резистентность полученных штаммов сохраняется при повторной инокуляции в течение 30 поколений и in vivo. В исследованиях Линекса показано, что переноса резистентности к другим микроорганизмам не происходит [15]. Энтерококки, содержащиеся в Линексе, обладают еще более высокой резистентностью к антибиотикам, чем лактобациллы и бифидобактерии [8].
При необходимости Линекс можно применять одновременно с антибактериальными и химиотерапевтическими средствами.
Эффективность компонентов Линекса и их комбинаций была доказана в многочисленных клинических исследованиях при острых и хронических заболеваниях желудочно-кишечного тракта у взрослых и детей. Наиболее хорошо изучены лакто- и бифидобактерии. Их эффективность, в частности, доказана при вирусных кишечных инфекциях, включая ротовирусный гастроэнтерит. При лечении острой инфекционной диареи у взрослых и детей, по результатам мета-анализа, монокомпонентные и комбинированные пробиотики, близкие по составу Линексу, являются эффективным дополнением к регидратационной терапии [16]. При вирусных кишечных инфекциях пробиотики относятся к препаратам выбора, поскольку антибиотики у этих пациентов не только не эффективны, но даже способствуют ухудшению дисбиоза и затрудняют дальнейшее лечение.
Пробиотики, содержащие Lactobacillus acidophilus и Enterococcus faecium, предупреждают развитие антибиотикоассоциированной диареи [17]. Эффективность их профилактического назначения была продемонстрирована в клинических исследованиях и подтверждена результатами мета-анализов [18]. В одном из последних мета-анализов, (декабрь 2006 г.) показано значительное снижение количества случаев антибиотикоассоциированной диареи при применении комбинированных пробиотиков [19].
Сравнительный клинико-лабораторный анализ выявил более высокую эффективность Линекса при острых кишечных инфекциях по сравнению c другим пробиотиком III поколения Ацилактом (содержит симбиотические штаммы лактобактерий), особенно в плане сокращения сроков диспептических явлений и более выраженного эубиотического эффекта на микрофлору кишечника, что, авторы связывают с синергизмом действия 3-х микробных компонентов, входящих в Линекс [22].
Бифидо- и лактобактерии также эффективны при диарее путешественников [23]. Их сочетанное применение позволяет предупреждать возникновение некротического энтероколита у новорожденных с очень низкой массой тела при рождении ( Представительство "Lek Pharmaceuticals"

Enterococcus faecium (энтерококки фэциум) — вид энтерококков, входящий в состав нормальной микрофлоры пищеварительного тракта человека, а также некоторых млекопитающих.
Энтерококки — молочнокислые грамположительные бактерии, не образующие спор и капсул, факультативные анаэробы (способные использовать энергию брожения и поэтому, жить и при больших и при ничтожных количествах кислорода). Оптимальная температура культивирования энтерококков от 35 до 37° С. Энтерококки осуществляют метаболизм бродильного типа, ферментируют разнообразные углеводы с образованием в основном молочной кислоты, но не газа, снижая кислотность среды до 4,2–4,6 pH. Энтерококки высокорезистентны к различным факторам внешней среды и дезинфицирующим средствам, могут длительное время сохранять жизнеспособность на предметах домашнего обихода, выдерживают нагревание до 60° С в течение 30 минут.
Энтерококки E. faecium колонизируют преимущественно тонкую кишку. Они обладают высокой ферментативной активностью, выраженным антагонизмом по отношению к условно-патогенным микробам (вырабатывают энтероцины), выживают в желчи.
Enterococcus faecium также является условно-патогенным микробом. С одной стороны, он необходимый для человека микроорганизм (в опытах на животных было доказано, что отсутствие Enterococcus faecium в кишечнике может привести к гибели животного от инфекции), но, с другой, может быть причиной различных заболеваний.
Энтерококки, в том числе Enterococcus faecium, всё чаще становятся причиной внутрибольничных инфекций. В течение последних десятилетий отмечен рост резистентности энтерококков к ванкомицину. В клиническом материале от человека, кроме Е. faecium, встречаются также Е. faecalis, Е. gilvus и E. pallens. E. faecium составляло 5–10 % от всех выделенных у человека энтерококков, 80–90% — E. faecalis (Бондаренко В.М. Суворов А.Н. Симбиотические энтерококки и проблемы энтерококковой оппортунистической инфекции). Частота резистентности к ванкомицину у штаммов Enterococcus faecium достигает 50 %, что гораздо выше, чем у штаммов наиболее часто встречающегося у человека Enterococcus faecalis (5%).
Enterococcus faecium могут быть причиной спонтанного бактериального перитонита.
Enterococcus faecium участвуют в реакции трансплантат против хозяина (Карпеева Ю.С. и др.).

В состав лекарственных средств-пробиотиков (Бифиформ, Линекс и другие) входит специально подобранный, отличающийся высоким уровнем антибиотикорезистентности и непатогенности штамм Enterococcus faecium SF68. В геноме этого штамма отсутствуют известные для патогенных клинических изолятов энтерококков гены вирулентности: gelE (gelatinize), sprE (serine protease), esp (extracellular surface protein), fsrB (virulence factor regulator), asa1 (aggregation substance). Enterococcus faecium SF68 чувствителен к ванкомицину, ампициллину, пиперациллину, хлорамфениколу, эритромицину, имипенему, ципрофлоксацину и фузидиевой кислоте и устойчивы к метициллину, цефуроксину, азтреонаму, мипрамину, тобрамицину, стрептомицину (Бондаренко В.М. Поликомпонентные пробиотики: терапевтический эффект при дисбиозах кишечника и механизм действия).

Беззародышевый водный субстрат продуктов обмена веществ Enterococcus faecium входит в состав противодиарейного лекарственного препарата Хилак форте.
Enterococcus faecium заселяет кишечник человека в первые дни жизни. Заселение энтерококками происходит более активно у детей, находящихся на грудном вскармливании.
- штамм Enterococcus faecium FAIR-E 198 используется при приготовлении сыра «фета»
- штаммы RZS C5 и DPC 1146 — сыр Чеддер
- штаммы CCM 4231 и RZS C13 — испанская колбаса холодного копчения
- штамм CTC49 2 — колбаса твердого копчения и копченая свинина
Антибиотики, активные в отношении Enterococcus faecium
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении Enterococcus faecium: ванкомицин, нифурател, доксициклин (не ко всем штаммам).
Для лечения энтерококковых инфекций, в том числе вызванных резистентными к ванкомицину штаммами Enterococcus faecium, применяется антибактериальный препарат линезолид.
Не активен в отношении Enterococcus faecium линкомицин.
Публикации и видео для профессионалов здравоохранения, затрагивающие роль Enterococcus faecium в заболеваниях ЖКТ и их лечении

Enterococcus faecium в систематике бактерий
По современным представлениям вид Enterococcus faecium относится к роду Enterococcus (энтерококки), который входит в семейство Enterococcaceae, порядок Lactobacillales, класс Bacilli, тип Firmicutes, <группу без ранга> Terrabacteria group, царство Бактерии.
По принятой ранее классификации энтерококки относились к стрептококкам группы D и Enterococcus faecium назывались Streptococcus faecium (стрептококки фэциум).
Темой сегодняшнего разговора будут одни из наиболее распространенных микроорганизмов из семейства Enterobacteriaceae — энтерококки, которые являются грамположительными кокками и факультативными анаэробами.
Автор: Трубачева Е.С., врач – клинический фармаколог
Темой сегодняшнего разговора будут одни из наиболее распространенных микроорганизмов из семейства Enterobacteriaceae — энтерококки, которые являются грамположительными кокками и факультативными анаэробами.
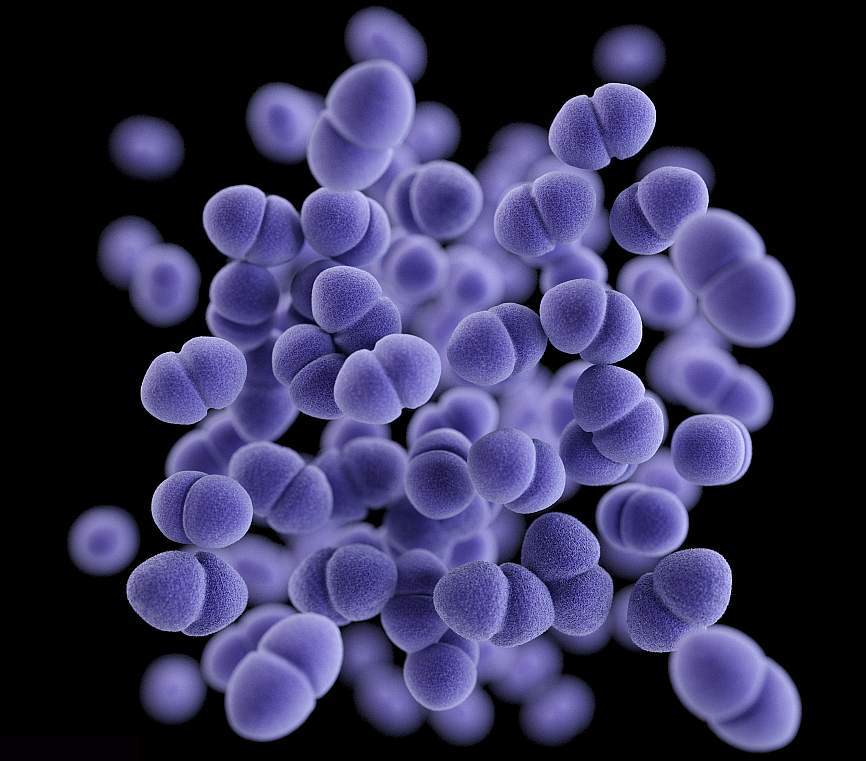
Микробиологические аспекты
Энтерококки входят в состав нормальной микрофлоры кишечника, обитают в основном в тонкой кишке и при этом, обнаруживаясь за пределами своей естественной среды обитания, являются возбудителями множества социально-значимых заболеваний. Наибольшее клиническое значение имеют E.faecalis и E.faecium.
Отличительным свойством энтерококков является их способность к образованию биопленок. О биопленках достаточно подробно мы рассуждали в статье, посвященной синегнойной палочке. И специфика течения многих заболеваний, вызванных энтерококками, объясняется именно пленкообразованием.
Клинические аспекты
Наиболее частым возбудителем внебольничных инфекций является E.faecalis — сюда относятся инфекции мочевыводящих путей и инфекционные эндокардиты у внутривенных наркозависимых пациентов.
E.faecium наиболее часто выявляется при нозокомиальных инфекциях — здесь преобладают так же инфекции мочевыводящих путей, но связанные с проведением инструментальных методов исследования, а также всевозможные виды бактеремий, связанных с медицинскими вмешательствами.
Когда мы можем думать о состояниях, вызванных энтерококками?
- Менингиты, как следствие черепно-мозговых травм, нейрохирургических вмешательств и при наличии антомических дефектов центральной нервной системы
- Перитониты любой этиологии
- Пельвиоперитониты (в составе микст-флоры)
- У пациентов с диабетической стопой
- У пациентов с инфекциями мочевыводящих путей, особенно в случаях их катетеризации
- Уросепсис
- У внутривенных наркозависимых — наравне с зеленящими стрептококками — энтерококки являются одними из наиболее частых возбудителей, а потому эмпирическая антибактериальная терапия должна перекрывать оба эти возбудителя
- Холангиты и инфекции билиарного тракта
- Катетер-ассоциированные инфекции (наряду с эпидермальными стафилококками)
Существуют следующие факторы риска инфицирования энтерококками:
- Длительные и неоднократные госпитализации
- Пациенты старшего возраста
- Пациенты с иммунодефицитами различной этиологии
- Лица, страдающие хроническими заболеваниями, такими как рак и диабет
- Пациенты с установленными мочевыми катетерами
- Пациенты на гемодиализе
- Пациенты с нейтропениями
- Наличие центральных венозных катетеров и дефекты ухода за оными
- Использование в стационарах антибиотиков широкого спектра действия (срабатывает принцип «свято место пусто не бывает», и энтерококки получают селективное преимущество на поле боя, где полегла остальная микрофлора)
- Недавно прооперированные пациенты или пациенты с открытыми ранами и язвами (высокий риск внутрибольничного инфицирования)
- Пациенты с установленными дренажами, а также интубированные пациенты (риск внутрибольничного инфицирования)
Как мы можем заметить, основную роль в развитии заболеваний, вызванных энтерококками, играет человеческий, точнее ятрогенный фактор. Энтерококки, как и вся остальная кишечная микрофлора, по воздуху летать не умеют, да и ножками не ходят, а потому главное в их нераспространении — чистота наших рук и соблюдение санитарно-противоэпидемических правил, написанных, как и большинство подобных документов (например, как ПДД), кровью, причем кровью пациентов.
Аспекты лечения
Их можно разделить на лекарственные и нелекарственные.
Аспекты медикаментозного лечения
Здесь автор отступит от правила и не отправит изучать вопрос по книжкам и таблицам, а попытается расписать антибактериальную терапию более подробно. Это связано и со спецификой самого возбудителя, и со спецификой контингента, имеющего заболевания, им вызванные.
Как уже упоминалось ранее, наряду с зеленящим стрептококком, а вообще намного чаще, энтерококк является основным возбудителем инфекционного эндокардита у лиц с внутривенной наркотической зависимостью. Проще говоря, если перед вами наркозависимый, и у него эндокардит трикуспидального клапана, то первое, о чем вы должны подумать, — это энтерококк, и эмпирическую терапию назначать с учетом этого знания. Конечно, могут быть варианты в виде того же зеленящего стрептококка или даже золотистого стафилококка, но эти возбудители более присущи пациентам с несанированной ротовой полостью и на митральном клапане (зеленящий) или после кардиохирургического вмешательства (золотистый стафилококк). Также на стафилококковый, а не энтерококковый характер поражения будет намекать снимок органов грудной клетки в прямой проекции, подозрительно напоминающий решето (один раз увидев стафилококковую метастатическую пневмонию ее уже ни с чем не перепутаешь).
Чем будем лечить?
Как ни странно это прозвучит в современных условиях, но препаратами выбора будут представители аминопенициллинового ряда — ампициллин (дешевле) или амоксициллин (в разы дороже) в обязательной комбинации с аминогликозидом — гентамицином (этот дешевле) или амикацином. Поэтому если вы работаете в стационаре скорой помощи и у вас попадаются пациенты данной категории — ампициллин для инъекций крайне рекомендуется иметь на полках аптеки в достаточных количествах. Это до сих пор дешево, сердито и очень эффективно в случаях терапии энтерококковых инфекций почти любой этиологии, и главное правильно рассчитать дозу, так как аминопенициллины относятся к так называемым время-зависимым препаратам (читаем первую и вторую часть здесь).
Повторимся еще раз — аминопенициллины в данном случае должны использоваться только в комбинации с аминогликозидами ввиду их синергетического действия в отношении энтерококков и ввиду вероятности микст-инфекции у подобной категории пациентов.
Вопрос по эмпирическому использованию ванкомицина остается дискуссионным — если в случае E.faecalis его можно назначать на уровне эмпирической терапии, когда у пациента имеется документированная аллергия на пенициллины (если конечно вам покрасили мазок по Граму или ваш стационар настолько крут, что имеет свой масс-спектрометр), то в случае E.faecium даже начинать не стоит — сразу зовите специально обученного человека, пусть он думает, что дальше делать.
Как уже было выше упомянуто, цефалоспорины назначать не стоит — энтерококки к ним природно устойчивы. А для того чтобы рука потянулась к карбопенемам, вам надо иметь доказанную мульти-резистентность возбудителя.
В случае развития резистентности к ампициллину используется его защищенная форма в виде ампициллина/сульбактама в комбинации с гентамицином. Дозировки рассчитываются по ампициллину.
Если совсем не повезло и лаборатория дала мультирезистентного фекального энтерококка, то используется комбинация ванкомицин (15 мг/кг/сут) в комбинации с гентамицином (8 мг/кг/сут) под жесточайшим контролем функции почек. Кроме того, в случае мультирезистентного возбудителя может быть использована комбинация имипенема с ампициллином, если, конечно, сможете обосновать ее для страховой компании — автор обосновывала, необходимый эффект получала, пациент не только выживал, но и выздоравливал. Только призывать к такого рода схемам, описанным, в основном, в американской литературе, автор ни в коем случае не будет, особенно в нынешние неспокойные времена. Сейчас наши основные документы по назначению любого вида терапии располагаются здесь.
В случае обнаружения резистентного E.faecium препаратом выбора становится линезолид и, не побоюсь этого слова, молитва, так как срок лечения не менее 8 недель, а кто нам столько препарата выдаст, да и прогноз при применении бактериостатика как-то не очень.
- Катетер-ассоциированные инфекции: помимо удаления катетера и обязательного исследования оного в микробиологической лаборатории, установки нового катетера в новом месте, также используется ампициллин в комбинации с гентамицином (в тех же дозировках, что описаны выше) либо ванкомицин (15 мг/кг/сут), если пациент демонстрирует аллергическую реакцию на оные, либо линезолид 600 мг каждые 12 часов, либо даптомицин 6 мг/кг/сут (если сможете его добыть).
- Инфекции мочевыводящих путей — здесь предпочтение стоит отдать пероральному амоксициллину в комбинации с клавулановой кислотой дважды в день. Вызвана сия рекомендации тем, что это чаще всего эта инфекция, присущая амбулаторному этапу, будет вызвана дикой и непуганой флорой, и заодно прикроетесь от вероятной кишечной палочки как второго возбудителя. Если ситуация развилась в стационаре — смотрим пункт первый и лечим по той же схеме.
- Отдельного упоминания требует лечение ванкомицин-резистентных энтерококков, так как видят их уже практически все доктора хирургического и реанимационного профиля. Арсенал наш в этом случае крайне беден — это, по сути, только линезолид да даптомицин. Линезодид является бактериостатиком, дающим высокие риски миелосупресии и тромбоцитопении через 2 недели от начала применения, которое должно составлять не менее 8 недель, но это, по сути, единственный шанс для пациента с энтероккоковым менингитом, устойчивым к ванкомицину, так как даптомицин, который надо найти, и как-то убедить его купить (стоит он просто безбожных денег), в мозговые оболочки не проникает в виду размера самой молекулы. Можно также упомянуть о тигециклине (100 мг нагрузочная и далее по 50 мг каждые 12 часов), но он тоже стоит как самолет. Поэтому самым лучшим вариантом лечения ванкомицин-устойчивых энтерококковых инфекций является их недопущение в принципе, то есть СанПин, СанПин и еще раз СанПин. А уж если такой пациент все-таки приключился, то необходима немедленная изоляция оного в отдельную палату, а еще лучше в изолятор, чтобы от него не переинфицировать всех вокруг, если вдруг кто-то про обработку рук забудет.
На этом краткий обзор энтерококковых инфекций закончим, и из кишечной микрофлоры у нас останется только королева внтурибольничных инфекций — ее величество Klebsiella, о которой мы поговорим в одной из следующих публикаций.
Читайте также:

